
- •Химическое отделение вятский государственный гуманитарный университет
- •М. А. Зайцев, о. В. Огородникова теория электролитической диссоциации
- •2. Механизм электролитической диссоциации веществ с различным типом химической связи
- •2.1. Диссоциация веществ с ионной структурой
- •2.2. Диссоциация электролитов, состоящих из полярных молекул
- •2.3. Гидраты. Кристаллогидраты
- •3. Свойства ионов
- •4. Степень диссоциации
- •5. Равновесия в растворах электролитов
- •5.1. Равновесия в растворах слабых и средних электролитов
- •5.2. Равновесия в растворах сильных электролитов
- •6. Электролитическая диссоциация воды (самоионизация). РН
- •Некоторые кислотно-основные индикаторы
- •7. Буферные системы
- •Значения рН некоторых объектов
- •8. Теории кислот и оснований
- •8.1. Диссоциация кислот и оснований в воде
- •8.2. Обобщенные теории кислот и оснований
- •8.2.1. Теория сольвосистем (сольвентная теория)
- •8.2.2. Протонная (протолитическая) теория
- •8.2.3. Электронная теория (теория Льюиса)
- •9. Ионные процессы
- •10. Гидролиз солей
- •Примеры решения задач
- •Решение
- •Решение
- •Решение
- •Решение
- •Решение
- •Решение
- •Решение
- •Решение
- •Решение
- •Решение
- •Решение
- •Решение
- •Решение
- •Решение
- •Решение
- •Решение
- •Решение
- •Решение
- •Литература
- •Краткие биографические сведения об ученых
3. Свойства ионов
Ионы по физическим, химическим и физиологическим свойствам отличаются от нейтральных атомов, из которых они образовались. Например, ионы натрия Na+ и хлорид-ионы Сl– не взаимодействуют с водой, не имеют цвета, запаха, неядовиты, тогда как металлический натрий (состоящий из атомов натрия) энергично взаимодействуют с водой, а вещество хлор (состоящее из молекул Cl2) в свободном состоянии – газ желто-зеленого цвета, ядовит, сильный окислитель.
Различные свойства атомов и ионов одного и того же элемента объясняются разным электронным строением этих частиц. Химические свойства металлов определяются валентными электронами, которые атомы металлов легко отдают и переходят в положительные ионы. Атомы неметаллов легко присоединяют электроны и переходят в отрицательные ионы. Ионы находятся в более устойчивых электронных состояниях, чем атомы.
Ионы имеют различную окраску. Гидратированные и негидратированные ионы s- и р-элементов обычно бесцветны. Так, бесцветны ионы Н+, Na+, К+, Ва2+, Al3+ и др. Ионы некоторых d-элементов имеют окраску. Окраска гидратированных и негидратированных ионов одного и того же d-элемента может быть различной. Например, негидратированные ионы Cu2+ – бесцветные, а гидратированные ионы меди Cu2+4Н2О – голубого цвета.
4. Степень диссоциации
Для количественной характеристики соотношения диссоциированных и недиссоциированных молекул электролита при данных условиях пользуются понятием степени электролитической диссоциации. Степень электролитической диссоциации равна отношению числа молекул, распавшихся на ионы, к общему числу молекул электролита, перешедших в раствор. Величина показывает долю молекул электролита, распавшихся на ионы:
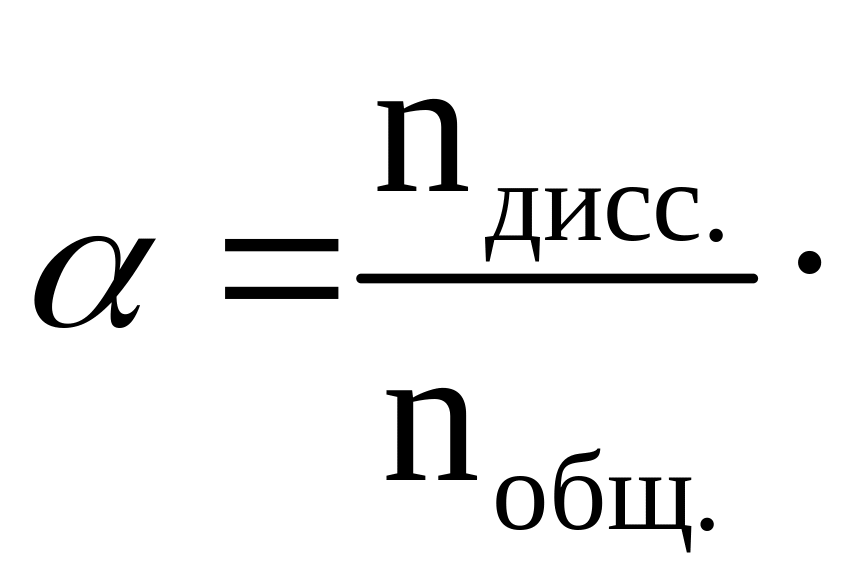 .
.
Степень диссоциации зависит от различных факторов:
1). Природа растворяемого вещества. Различные вещества диссоциируют в разной степени. Например, муравьиной кислоты НСООН при одинаковых условиях больше уксусной кислоты СН3СООН.
2). Концентрация раствора. При уменьшении концентрации электролита, т. е. при разбавлении раствора, степень диссоциации увеличивается, так как увеличиваются расстояния между ионами в растворе и уменьшается возможность соединения их в молекулы.
3). Температура. При повышении температуры степень диссоциации, как правило, увеличивается.
По степени диссоциации электролиты подразделяют на сильные, слабые и средней силы.
Сильные электролиты – это электролиты, которые в водных растворах полностью диссоциируют на ионы, т. е. их степень диссоциации равна 1 (100%).
Слабыми электролитами называются электролиты, степень диссоциации которых стремится к 0.
Электролитами средней силы являются электролиты с промежуточными значениями степени диссоциации.
К сильным электролитам в водных растворах относятся почти все соли, многие неорганические кислоты (HNO3, H2SO4, HClO4, HCl, HBr, HI и др.) и гидроксиды щелочных и щелочноземельных металлов.
Электролитами средней силы являются некоторые органические и неорганические кислоты (щавелевая, муравьиная, сернистая, фосфорная и др.).
К слабым электролитам принадлежат такие кислоты, как H2S, HCN, H2SiO3, H3BO3, гидроксиды многих d-элементов [Cu(OH)2, Cr(OH)3 и др.], а также немногие соли (HgCl2, CdCl2, ZnCl2, Fe(SCN)3 и др.).
Обратите внимание! Растворимость и степень диссоциации не связаны друг с другом.
Например,
СаСО3
является электролитом, несмотря на то,
что нерастворим. В насыщенном растворе
его содержится 610–3
г/л СаСО3,
образующих по 3,61019
ионов Са2+
и СО![]() .
Причем, СаСО3
является сильным электролитом, т. к.
= 1.
.
Причем, СаСО3
является сильным электролитом, т. к.
= 1.
В то же время растворимые хлорид ртути (II), хлорид цинка, роданид железа (III), уксусная кислота и др. являются слабыми электролитами.
