
- •Химическое отделение вятский государственный гуманитарный университет
- •М. А. Зайцев, о. В. Огородникова теория электролитической диссоциации
- •2. Механизм электролитической диссоциации веществ с различным типом химической связи
- •2.1. Диссоциация веществ с ионной структурой
- •2.2. Диссоциация электролитов, состоящих из полярных молекул
- •2.3. Гидраты. Кристаллогидраты
- •3. Свойства ионов
- •4. Степень диссоциации
- •5. Равновесия в растворах электролитов
- •5.1. Равновесия в растворах слабых и средних электролитов
- •5.2. Равновесия в растворах сильных электролитов
- •6. Электролитическая диссоциация воды (самоионизация). РН
- •Некоторые кислотно-основные индикаторы
- •7. Буферные системы
- •Значения рН некоторых объектов
- •8. Теории кислот и оснований
- •8.1. Диссоциация кислот и оснований в воде
- •8.2. Обобщенные теории кислот и оснований
- •8.2.1. Теория сольвосистем (сольвентная теория)
- •8.2.2. Протонная (протолитическая) теория
- •8.2.3. Электронная теория (теория Льюиса)
- •9. Ионные процессы
- •10. Гидролиз солей
- •Примеры решения задач
- •Решение
- •Решение
- •Решение
- •Решение
- •Решение
- •Решение
- •Решение
- •Решение
- •Решение
- •Решение
- •Решение
- •Решение
- •Решение
- •Решение
- •Решение
- •Решение
- •Решение
- •Решение
- •Литература
- •Краткие биографические сведения об ученых
10. Гидролиз солей
Водные растворы солей в зависимости от природы образующих их кислот и оснований могут быть кислыми, щелочными и нейтральными. Кислотность или основность водных растворов солей объясняется протеканием в них реакций гидролиза. В широком понимании гидролиз – это процесс взаимного разложения воды и реагирующего с ней вещества. Гидролиз соли – это взаимодействие ионов соли с молекулами воды, приводящее к образованию слабого электролита.
Характер протекания гидролиза, т. е. природа продуктов и реакция среды получающегося раствора, зависят от сочетания силы кислоты и основания, образующих соль, поэтому возможны 4 варианта гидролиза солей:
1. Соль образована анионами слабой кислоты и катионами сильного основания. Рассмотрим гидролиз ацетата натрия. Эта соль в водном растворе диссоциирует на ионы натрия и ацетат-ионы:
CH3COONa ⇄ Na+ + CH3COO–.
С водой возможна реакция того иона, который с одним из ионов воды дает слабый электролит:
СН3СОО– + Н2О ⇄ СН3СООН + ОН–.
Образующиеся гидроксид-ионы обусловливают щелочную среду раствора (рН > 7).
Применяя закон действующих масс к данному гидролитическому равновесию с учетом, что концентрация воды в разбавленном растворе практически не изменяется, запишем выражение константы равновесия гидролиза (константы гидролиза КГ):
Кг
=
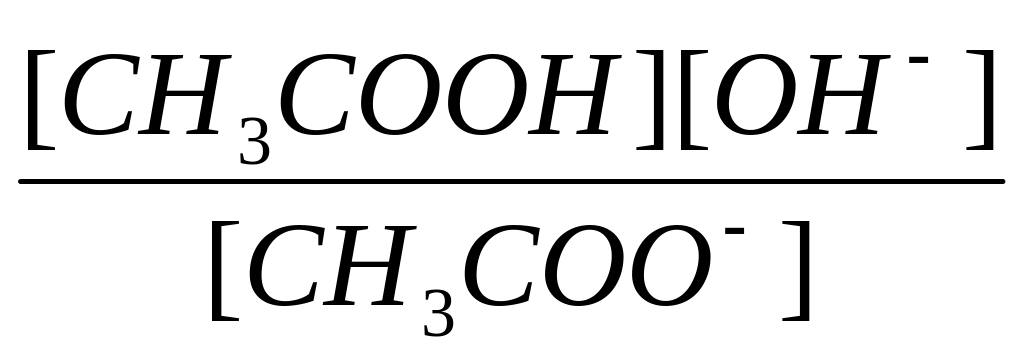 .
.
Умножив числитель и знаменатель на [H+], получим:
Кг
=
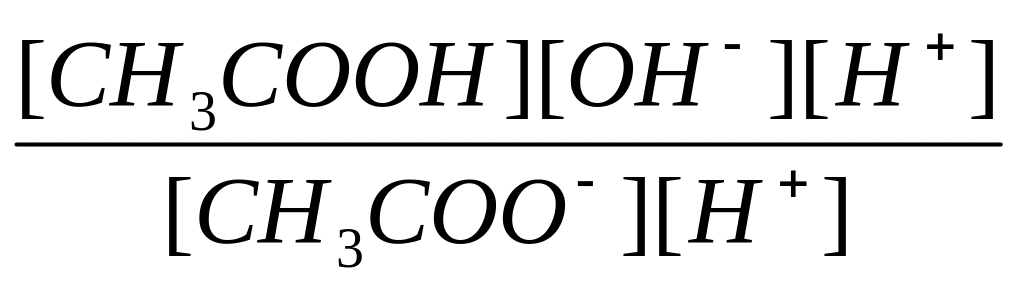 =
=
![]() .
.
Чем меньше константа диссоциации кислоты, образующей соль, тем сильнее положение равновесия смещено в сторону продуктов и тем выше щелочность раствора, т. е. больше рН.
Гидролиз может протекать ступенчато. Например, гидролиз карбоната натрия:
СО32– + Н2О ⇄ НСО3– + ОН– (I ступень);
НСО3– + Н2О ⇄ Н2СО3 + ОН– (II ступень).
Причем преимущественно гидролиз идет по первой ступени.
2. Соль образована анионами сильной кислоты и катионами слабого основания. Рассмотрим гидролиз хлорида аммония. Эта соль диссоциирует в растворе на ионы аммония и хлорид-ионы:
NH4Cl = NH4+ + Cl–.
С водой взаимодействуют ионы аммония:
NH4+ + Н2О = NH3Н2О + Н+.
Образующиеся ионы водорода обусловливают кислую среду раствора (рН < 7). Константа гидролиза хлорида аммония:
Кг
=
 =
=
 =
=
![]() .
.
Для данного типа солей также может быть ступенчатый гидролиз. Например, гидролиз хлорида алюминия:
Al3+ + H2O ⇄ AlOH2+ + H+ (I ступень);
AlOH2+ + H2O ⇄ Al(OH)2+ + H+ (II ступень);
Al(OH)2+ + H2O ⇄ Al(OH)3 + H+ (III ступень).
Причем преимущественно гидролиз протекает по первой ступени.
3. Соль образована анионами слабой кислоты и катионами слабого основания. Рассмотрим гидролиз ацетата аммония. Данная соль диссоциирует в растворе на ионы аммония и ацетат-ионы:
CH3COONH4 ⇄ NH4+ + CH3COO–.
С водой взаимодействуют и ионы аммония, и ацетат-ионы:
NH4+ + CH3COO– + H2O ⇄ NH4OH + CH3COOH.
Среда раствора определяется относительной силой образующихся кислоты и основания. Константа гидролиза данной соли:
Кг
=
![]() =
=
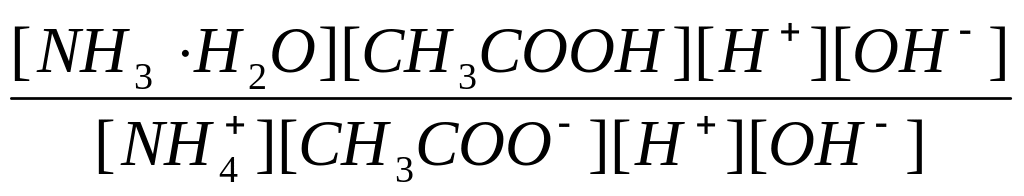 =
=
=
![]()
4. Соли, образованные анионами сильной кислоты и катионами сильного основания гидролизу не подвергаются.
Гидролиз, сопровождающийся образованием осадка или газа, называется необратимым гидролизом.
