
- •3. Матеріали і обладнання :
- •4. Порядок проведення роботи.
- •4.1. Виявлення карбону та гідрогену.
- •Хімізм процесу:
- •Виявлення сульфуру.
- •Хімізм реакцій:
- •4.4. Виявлення хлору. Реакція ф.Ф. Бейльштейна.
- •Висновок:
- •Лабораторна робота № 2
- •3. Матеріали і обладнання:
- •Порядок проведення роботи:
- •4.1. Одержання метану і вивчення його властивостей.
- •4.3.Відношення рідких алканів до окислювачів.
- •Горіння метану
- •Одержання етилену та його горіння.
- •Хімізм реакцій:
- •Приєднання до етилену брому.
- •Відношення етилену до окислювачів.
- •Одержання ацетилену і його горіння.
- •Приєднання до ацетилену брому.
- •Відношення ацетилену до окислювачів.
- •Утворення ацетиленіду срібла.
- •Контрольні запитання
- •Матеріали і обладнання :
- •Порядок проведення роботи .
- •Горіння бензену.
- •Дія перманганату калію.
- •4.4.Окислення гомологів бензолу.
- •Нітрування бензену.
- •Нітрування нафталену.
- •Сублімація нафталену.
- •Порядок проведення роботи.
- •Відношення спиртів до індикатора.
- •Утворення і гідроліз алкоголятів.
- •Хімізм реакцій:
- •Розчинення фенолу у воді.
- •Кольорові реакції багатоатомних фенолів з хлоридом заліза.
- •Матеріали і обладнання:
- •Порядок проведення роботи.
- •Кислотні властивості карбонових кислот.
- •4.2. Окислення мурашиної кислоти перманганатом калію.
- •4.3. Розклад мурашиної кислоти при нагріванні з концентрованою сульфатною кислотою.
- •4.4.Одержання натрієвої солі щавлевої кислоти.
- •4.5. Розкладання щавлевої кислоти при нагріванні.
- •4.5.3. Хімізм реакцій:
- •4.6. Розклад щавлевої кислоти при нагріванні з концентрованою сульфатною кислотою.
- •4.6.3.Хімізм реакцій:
- •4.7. Окислення щавлевої кислоти калій перманганатом.
- •4.8. Приєднання брому до олеїнової кислоти.
- •4.9. Одержання оцтово етилового естеру.
- •4.9.3.Хімізм реакцій:
- •4.10.Взаємодія оцтового ангідриду з водою .
- •4.11.Взаємодія оцтового ангідриду з лугом.
- •4.11.3.Хімізм реакцій:
- •4.12.3.Хімізм реакцій:
- •4.13. Розчинність мила у воді.
- •4.14.Виділення вільних жирних кислот із мила.
- •4.14.3.Хімізм реакцій:
- •4.15.Гідроліз спиртового розчину мила.
- •4.15.3.Хімізм реакцій:
- •4.16.Утворення нерозчинних кальцієвих солей жирних кислот.
- •4.16.3.Хімізм реакцій:
- •Лабораторна робота № 6.
- •3. Матеріали і обладнання:
- •4.Порядок проведення роботи.
- •4.1.Одержання нітробензену.
- •4.2.Одержання динітробензену.
- •4.3. Нітрування фенолу.
- •4.4. Одержання метиламіну з ацетаміду.
- •4.4.3. Хімізм реакцій:
- •4.5. Властивості амінів жирного ряду.
- •4 .5.3. Хімізм реакцій:
- •4.7.3.Хімізм реакцій:
- •4.13. Діазотування сульфанілової кислоти.
- •4 .13.3. Хімізм реакцій:
- •4.14.Одержання геліантину.
- •4.14.3. Хімізм реакцій:
- •4.15. Властивості геліантину.
- •4.15.3. Хімізм реакцій:
- •3. Матеріали і обладнання :
- •4.Порядок проведення роботи.
- •4.2.Окислення глюкози аміачним розчином оксиду срібла
- •4.3.Окислення глюкози лугом.
- •4.4.3. Хімізм реакцій:
- •4.5.Кислотний гідроліз сахарози.
- •4.5.3. Хімізм реакцій:
- •4.6.Наявність відновлюючої здатності у лактози.
- •4.6.3. Хімізм реакцій:
- •4.7.Реакція крохмалю з йодом.
- •4.10.Взаємодія клітковини з лугом.
- •4.12.Одержання азотокислих ефірів (естерів) клітковини.
- •4.12.3. Хімізм реакцій:
- •3. Матеріали і обладнання:
- •4.Порядок проведення роботи.
- •4.2.3. Хімізм реакцій:
- •4.3.Реакція з аміачним комплексом срібла.
- •4.3.3. Хімізм реакцій:
- •4.4.Кольорові реакції на білки. Біуретова реакція.
- •4.5.Ксантопротеїнова реакція.
- •4.6.Згортання білків при нагріванні.
- •4.7.Осадження білків концентрованими мінеральними кислотами.
- •4.8.Осадження білків солями важких металів.
Спостереження: з’являється темно-синє забарвлення.
Хімізм реакцій:
Н
 2С
– ОН
HO
– CH2
H2C
– O
O
– CH2
2С
– ОН
HO
– CH2
H2C
– O
O
– CH2
Н С – ОН + НО – Cu – OH + HO – CH → HC – O → Cu ← O – CH + 2H2O
Н2С – ОН HO – CH2 HOH2C H H CH2OH
В исновок: кислотні властивості трьохатомного спирту більші ніж одноатомного, збільшення кількості гідроксильних груп підвищує кислотний характер.Отримання диетилового ефіру.
Хід роботи: в суху пробірку внести 2 краплі етилового спирту і 2 краплі сульфатної кислоти. Суміш обережно нагріти над полум’ям пальника до побуріння розчину. До гарячої суміші дуже обережно добавити ще 2 краплі етилового спирту.
С
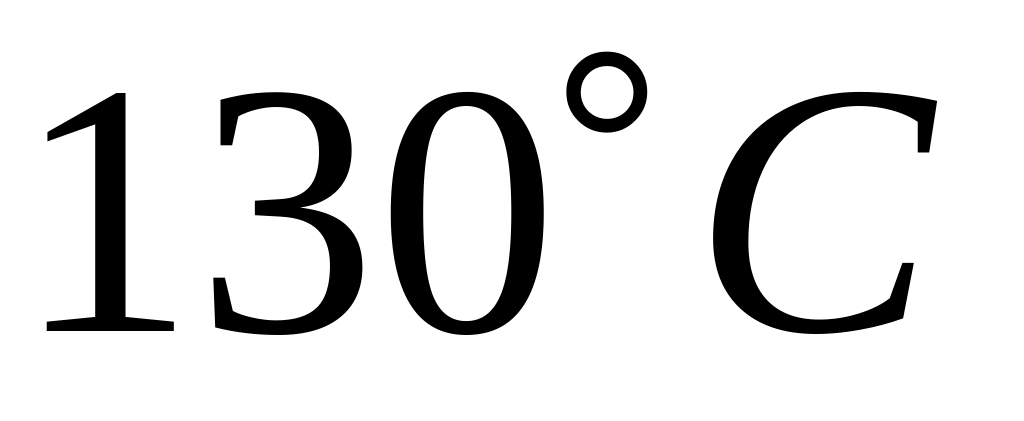 постереження:
відчувається характерний запах
діетилового ефіру.
постереження:
відчувається характерний запах
діетилового ефіру.
Х
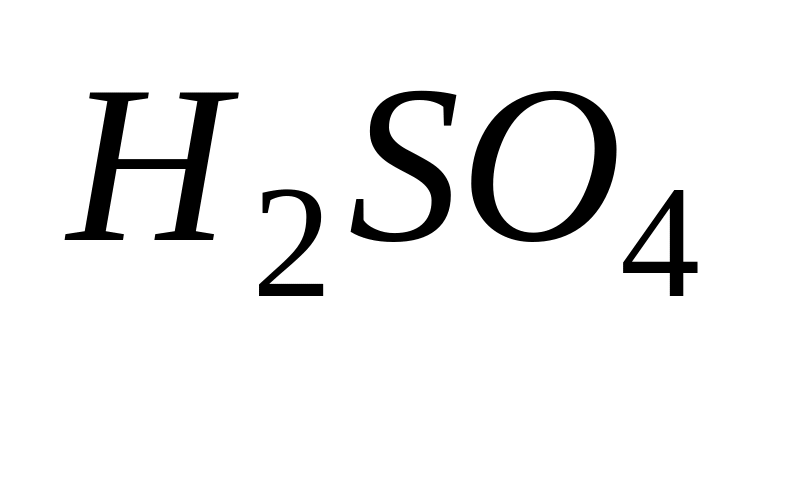 імізм
реакцій: С2Н5ОН
+ НОС2Н5
→ С2Н5
– О – С2Н5
+ Н2O
імізм
реакцій: С2Н5ОН
+ НОС2Н5
→ С2Н5
– О – С2Н5
+ Н2OВисновок: відбувається міжмолекулярна дегідратація
Розчинення фенолу у воді.
Хід роботи: поміщають у пробірку 2 краплі рідкого фенолу, добавити 2 краплі води і збовтують. Дати суміші відстоятися. Пізніше суміш у пробірці розшаровується: верхній шар - розчин фенолу у воді, нижній - розчин води у фенолі. Обережно нагріти пробірку над пальником.
Спостереження: утворюється мутна вода. Рідина – емульсія фенолу.
Висновок: фенол погано розчиняється у холодній воді.
Одержання феноляту натрію.Хід роботи: в пробірку поміщають 4 краплі емульсії фенолу у воді і добавляють 2 краплі розчину їдкого натрію. Швидко збовтують.Спостереження: утворюється безбарвний розчин.
Хімізм реакцій: С6Н5 – ОН + NaOH → C6H5 – ONa + H2O
Висновок: феноли володіють кислотними властивостями.Розклад феноляту натрію хлоридною кислотою.
Хід роботи: в пробірку поміщаємо 4 краплі фенолу у воді і добавляють 2 краплі розчину їдкого натрію, добавляють каплю розчину хлоридної кислоти.
Спостереження: виділяється вільний фенол у вигляді емульсії.
Хімізм реакцій: С6Н5 – ONa + HCl → C6H5 – OH + NaCl
Висновок: розчини фенолятів лужних металів володіють лужною реакцією.Реакція фенолу з хлоридом заліза (ІІІ) .
Хід роботи: в пробірку помістити 2 краплі розчину фенолу, добавити 3 краплі води і 1 краплю розчину хлориду заліза.
Спостереження: з’являється червоно-фіолетове забарвлення
Хімізм реакцій: С6Н5ОН + FeCl3 → C6H5OFeCl2 + HCl
Висновок: феноли з FrCl3 дають кольорову реакцію.
Одержання трибромфенолу.
Хід роботи: в пробірку вводять 2 краплі бромної води і добавляють краплю водного розчину фенолу.
Спостереження: розчин знебарвлюється, випадає білий осад.
![]()


![]()
Х
 імізм
реакцій:
+ 3Br2
→ Br
OH
+ 3HBr
імізм
реакцій:
+ 3Br2
→ Br
OH
+ 3HBr

Висновок: гідроксильна група відноситься до найбільш сильних орто-пара-орієнтантів.
Нітрування фенолу.
Хід роботи: в пробірку поміщають декілька кристалів фенолу, 2-3 краплі води і мішають до утворення однорідного розчину. В другу пробірку поміщають 3 краплі НNО3 (конц.) і 3 краплі води. Розбавлену НNО3 по краплях переливають до рідкого фенолу, весь час збовтуючи і охолоджуючи реакційну пробірку. Потім реакційну суміш виливають в пробірку з декількома каплями води. Отвір пробірки закривають корком з газовідвідною трубкою і відганяють о-нітрофенол в чисту, суху пробірку-приймач.
Спостереження: о-нітрофенол має характерний мигдальний запах.
 NO2
NO2



 → ОН
→ ОН
Х
 імізм
реакцій: + Н
NO3
+ Н2О
імізм
реакцій: + Н
NO3
+ Н2О
 NO2
NO2
→

ОН
Висновок: Гідроксильна група активує ядро, що її містить.
