
- •3. Матеріали і обладнання :
- •4. Порядок проведення роботи.
- •4.1. Виявлення карбону та гідрогену.
- •Хімізм процесу:
- •Виявлення сульфуру.
- •Хімізм реакцій:
- •4.4. Виявлення хлору. Реакція ф.Ф. Бейльштейна.
- •Висновок:
- •Лабораторна робота № 2
- •3. Матеріали і обладнання:
- •Порядок проведення роботи:
- •4.1. Одержання метану і вивчення його властивостей.
- •4.3.Відношення рідких алканів до окислювачів.
- •Горіння метану
- •Одержання етилену та його горіння.
- •Хімізм реакцій:
- •Приєднання до етилену брому.
- •Відношення етилену до окислювачів.
- •Одержання ацетилену і його горіння.
- •Приєднання до ацетилену брому.
- •Відношення ацетилену до окислювачів.
- •Утворення ацетиленіду срібла.
- •Контрольні запитання
- •Матеріали і обладнання :
- •Порядок проведення роботи .
- •Горіння бензену.
- •Дія перманганату калію.
- •4.4.Окислення гомологів бензолу.
- •Нітрування бензену.
- •Нітрування нафталену.
- •Сублімація нафталену.
- •Порядок проведення роботи.
- •Відношення спиртів до індикатора.
- •Утворення і гідроліз алкоголятів.
- •Хімізм реакцій:
- •Розчинення фенолу у воді.
- •Кольорові реакції багатоатомних фенолів з хлоридом заліза.
- •Матеріали і обладнання:
- •Порядок проведення роботи.
- •Кислотні властивості карбонових кислот.
- •4.2. Окислення мурашиної кислоти перманганатом калію.
- •4.3. Розклад мурашиної кислоти при нагріванні з концентрованою сульфатною кислотою.
- •4.4.Одержання натрієвої солі щавлевої кислоти.
- •4.5. Розкладання щавлевої кислоти при нагріванні.
- •4.5.3. Хімізм реакцій:
- •4.6. Розклад щавлевої кислоти при нагріванні з концентрованою сульфатною кислотою.
- •4.6.3.Хімізм реакцій:
- •4.7. Окислення щавлевої кислоти калій перманганатом.
- •4.8. Приєднання брому до олеїнової кислоти.
- •4.9. Одержання оцтово етилового естеру.
- •4.9.3.Хімізм реакцій:
- •4.10.Взаємодія оцтового ангідриду з водою .
- •4.11.Взаємодія оцтового ангідриду з лугом.
- •4.11.3.Хімізм реакцій:
- •4.12.3.Хімізм реакцій:
- •4.13. Розчинність мила у воді.
- •4.14.Виділення вільних жирних кислот із мила.
- •4.14.3.Хімізм реакцій:
- •4.15.Гідроліз спиртового розчину мила.
- •4.15.3.Хімізм реакцій:
- •4.16.Утворення нерозчинних кальцієвих солей жирних кислот.
- •4.16.3.Хімізм реакцій:
- •Лабораторна робота № 6.
- •3. Матеріали і обладнання:
- •4.Порядок проведення роботи.
- •4.1.Одержання нітробензену.
- •4.2.Одержання динітробензену.
- •4.3. Нітрування фенолу.
- •4.4. Одержання метиламіну з ацетаміду.
- •4.4.3. Хімізм реакцій:
- •4.5. Властивості амінів жирного ряду.
- •4 .5.3. Хімізм реакцій:
- •4.7.3.Хімізм реакцій:
- •4.13. Діазотування сульфанілової кислоти.
- •4 .13.3. Хімізм реакцій:
- •4.14.Одержання геліантину.
- •4.14.3. Хімізм реакцій:
- •4.15. Властивості геліантину.
- •4.15.3. Хімізм реакцій:
- •3. Матеріали і обладнання :
- •4.Порядок проведення роботи.
- •4.2.Окислення глюкози аміачним розчином оксиду срібла
- •4.3.Окислення глюкози лугом.
- •4.4.3. Хімізм реакцій:
- •4.5.Кислотний гідроліз сахарози.
- •4.5.3. Хімізм реакцій:
- •4.6.Наявність відновлюючої здатності у лактози.
- •4.6.3. Хімізм реакцій:
- •4.7.Реакція крохмалю з йодом.
- •4.10.Взаємодія клітковини з лугом.
- •4.12.Одержання азотокислих ефірів (естерів) клітковини.
- •4.12.3. Хімізм реакцій:
- •3. Матеріали і обладнання:
- •4.Порядок проведення роботи.
- •4.2.3. Хімізм реакцій:
- •4.3.Реакція з аміачним комплексом срібла.
- •4.3.3. Хімізм реакцій:
- •4.4.Кольорові реакції на білки. Біуретова реакція.
- •4.5.Ксантопротеїнова реакція.
- •4.6.Згортання білків при нагріванні.
- •4.7.Осадження білків концентрованими мінеральними кислотами.
- •4.8.Осадження білків солями важких металів.
Нітрування бензену.
Хід роботи: В суху пробірку поміщають 2 краплі концентрованої нітратної кислоти, 3 краплі концентрованої сульфатної кислоти. Одержану суміш охолоджують і додають 2 краплі бензену, поміщають на водяну баню, нагріту 50- 55С на 2 хв.
С
 постереження:
коли
вміст пробірки перелити в іншу пробірку
з водою на дно осяде важкий жовтуватий
нітробензен.
постереження:
коли
вміст пробірки перелити в іншу пробірку
з водою на дно осяде важкий жовтуватий
нітробензен.Х імізм реакцій: + НО – NO2 → + H2O
Висновок: за допомогою даного досліду ми одержали нітробензен.
Нітрування нафталену.
Хід роботи: в суху пробірку поміщають кристалик нафталену, 3 краплі нітратної кислоти, 2 краплі сульфатної кислоти. На водяній бані суміш нагрівають 2-3 хв. Гарячий розчин виливають у пробірку з холодною водою.
С
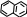 постереження:
нафтален опускається на дно у вигляді
оранжевої маслянистої рідини, яка
твердне при збовтуванні.
постереження:
нафтален опускається на дно у вигляді
оранжевої маслянистої рідини, яка
твердне при збовтуванні.Х
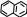 імізм
реакцій:
+ НО – NO2
→ + H2O
імізм
реакцій:
+ НО – NO2
→ + H2OВисновок: ми добули нітронафтален. Нітрування нафталену проходить легше ніж нітрування бензену.
Сублімація нафталену.
Хід роботи: в суху пробірку поміщають кристалики нафталену і закріплюють її у штативі. Верхню половину пробірки обгортають вологим фільтрувальним папером і починають обережно нагрівати дно пробірки.
Спостереження: у охолоджуваній частині пробірки утворяться кристали нафталену.
Висновок: сублімація нафталену є одним із способів його очистки.
Порядок проведення роботи.
Відношення спиртів до індикатора.
Хід роботи: в пробірку дають 3 краплі води і додають 2 краплі
етанолу. Перевіряємо на фенолфталеїн і лакмус.
Спостереження: забарвлення індикаторів не змінюється
Висновок: спирти – практично нейтральна речовина.
Утворення і гідроліз алкоголятів.
Хід роботи: в суху пробірку поміщають металічний натрій і додають 3 краплі етилового спирту і закривають пробірку пальцем. По закінченню реакції підносять пробірку до полум’я пальника і забирають палець. В отворі пробірки загоряється водень, який виділяється. Залишок етилату натрію розчиняється в 2-3 краплях дистильованої води і додають 1 краплю фенолфталеїну.
Спостереження: з’являється малинове забарвлення
Хімізм реакцій: С2Н5ОН + Na → C2H5ONa + ½H2 C2H5ONa + H – OH → C2H5OH + NaOH
Висновок: атоми водню гідроксильних груп в спиртах проявляють певну активність. В спиртах слабо виражені кислотні властивості.Окислення етилового спирту купрум (ІІ) оксидом.
Хід роботи: в пробірку поміщають 2 краплі етилового спирту. Тримаючи спіраль з мідною дротиною пінцетом нагрівають її в полум’ї пальника до появи чорного нальоту CuO. Гарячу спіраль опускають в пробірку з етиловим спиртом.
С постереження: чорна поверхня спіралі стає золотистою внаслідок відновлення CuO. Відчуваємо запах оцтового альдегіду (запах яблука). O
Хімізм реакцій: С2Н5ОН + CuO → CH3 – C + Cu + H2O
 H
H
Висновок: окислення С2Н5ОН CuO є якісною реакцією.
Окислення етилового спирту хромовою сумішшю.
Хід роботи: в суху пробірку поміщають 2 краплі етилового спирту і додають 1 краплю розчину H2SO4 і 2 краплі хромової суміші. Нагрівають.
Спостереження: розчин стає синьо-зеленого кольору, одночасно відчувається запах оцтового альдегіду.
Х імізм реакцій: O
3 С2Н5ОН + K2Cr2O7 + H2SO4 → 3CH3 – C + Cr2(SO4)3 + K2SO4 + 7H2O
4.4.4 Висновок: при окисленні спиртів, в першу чергу окислюється карбон, біля якого знаходиться гідроксильна група.Взаємодія гліцерину з купруму (ІІ) гідрооксидом.
Хід роботи: помістити в пробірку 2 краплі розчину сульфату міді, 2 краплі розчину їдкого натру і перемішати, в пробірку додати 1 краплю гліцерину і розбовтати.
