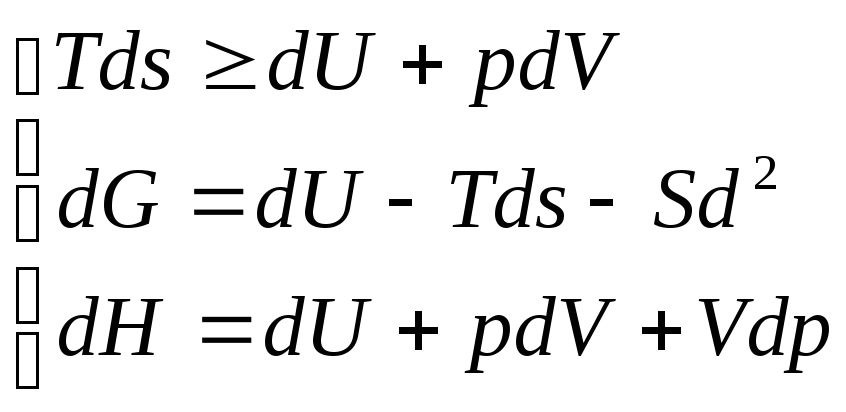Шпоры по химии для экзамена
.doc
|
|
|
|
|
|
|
3. Равновесие на границе раствор-электрод. Электрохимические цепи.
Активные металлы растворяются в воде даже при присутствии там ионов этих металлов. Неактивные металлы будут растворяться в воде только если в ней не присутствуют ионы этих металлов, если же они присутствуют, но потенциалопределяющим будет процесс адсорбции ионов на поверхности металла. Таким образом активные Ме всегда приобретают отрицательный потенциал, а неактивные могут приобретать как отрицательный, так и положительный потенциал. Растворение металлов происходит под действием полярных молекул воды, а растворенные в воде соли лишь препятствуют процессу растворения Ме.
Металл становится заряженным отрицательно, а раствор – положительно. Положительно заряженные ионы из раствора притягиваются у отрицательно заряженной поверхности электрода. На границе «раствор-электрод» возникает двойной электрический слой. Соответственно между металлом и раствором возникает разность потенциалов, которая называется электродным потенциалом. Наряду с реакцией окисления идет реакция восстановления ионов Ме:
При некотором значении электродного потенциала устанавливается равновесие на границе «раствор-электрод»
Равновесие имеет динамический характер. Процессы идут при равновесии с одинаковой скоростью в прямом и обратном направлениях. Установившийся потенциал называют равновесным электродным потенциалом.
Электрохимической цепью называют совокупность последовательно соединенных проводников с ионной проводимостью (проводники 2-ого рода) и проводников с электронной проводимостью (1-ого рода) Пример электрохимической цепи:
|
|
|
4. Водородный электрод. Электродные реакции. Электродный потенциал.
В качестве классического электрода сравнения используется водородный электрод. При стандартных условиях (T=298K, P=101кПа, [H2SO4=1моль/л] потенциал водородного электрода принято считать равным 0. Следовательно, измерив ЭДС элемента, одним из электродов которого является водородный электрод, можно рассчитать стандартный электродный потенциал другого электрода.
На электроде происходит реакция окисления металла, которую можно условно записать
На границе «раствор-электрод» возникает двойной электрический слой. Соответственно между металлом и раствором возникает разность потенциалов, которая называется электродным потенциалом. Наряду с реакцией окисления идет и обратная реакция восстановления.
При некотором значении электродного потенциала устанавливается равновесие на границе «раствор-электрод»
Или в упрощенном виде
Установившийся потенциал называют равновесным электродным потенциалом.
|
|
|
5. Элемент Якоби-Даниэля. Уравнение Нернста.
Г Электродный ключ – стеклянная трубка, заполненная агар-агаром, который пропитан ионами солей и таким образом ЭК обладает электродной проводимостью. Схема
цепи:
Анод:
Катод:
Катодная реакция осуществляется за счет электронов, которые переходят с анода на катод по металлическому проводнику, т.е. по нему течет электрический ток. Таким образом в гальваническом элементе Якоби-Даниэля происходит окислительно-восстановительная реакция, разнесенная в пространстве.
Уравнение Нернста.
R – универсальная газовая постоянная Т – температура F – число Фарадея n – заряд ионов
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Обладают собственной электронно-дырочной проводимостью.
|
|
|
11. Получение полупроводникового кремния и бинарных соединений. Технический кремний получают из кварцевого песка восстановлением коксом в дуговых печах с графитовыми электродами. Получаемый кремний содержит ~0,3 % примесей. Растворением в кислоте и последующем осаждением концентрацию примесей снижают до 0,2 %. Для получения кремния высокой чистоты из технического кремния образуют летучие соединения кремния – галогениды: SiCL4, SiHCL3, SiJ4. ИЗ этих соединений кремний полупроводниковой чистоты получают одним из следующих способов: - восстановлением газообразного тетрахлорида кремния металлическим цинком в кварцевой трубке при t ~ 950 гр. Цельсия по реакции: SiCL4 + 2Zn => Si + 2ZnCl2; - восстановлением тетрахлорида кремния, или трихлорсилана водородом по реакции: SiCL4 + H2 => Si + 4HCL; SiHCl3 + H2 => Si + 3HCL; - термическим разложением моносилана по реакции: SiH4 => Si + 2H2; - термическим разложением газообразного тетрайодида кремния при t ~ 1000 гр. Цельсия на танталовой ленте по реакции: SiI4 => Si + 2I2 Полученный по одному из рассмотренных способов кремний подвергают зонной плавке. Затем из полученного поликристаллического кремния выращивают монокристаллы. Многие полупроводниковые соединения типа A-III B-V получают прямым синтезом (из А и В) при контролируемых условиях в вакууме, или в среде инертного газа. Например, арсенид галлия получают прямым синтезом из галлия и мышьяка в кварцевых ампулах в вакууме: Ga + As => GaAs Антимонид индия, обладающий очень высокой подвижностью электронов (~ 1000 см^2 * В^-1 * с^-1), так же получают прямым синтезом в кварцевых ампулах в вакууме: In + Sb => InSb Бинарные полупроводниковые соединение типа A-III B-V, так же как полупроводниковый кремний, подвергают глубокой очистке. |
Некоторые соединения A-II B-VI, как , например теллурид кадмия, получают прямым синтезом из кадмия и теллура: Cd + Te => CdTe Сульфид цинка, широко используемый в электронной промышленности, получают из природного сырья – цинковой обмонки, растворяя ее в серной кислоте. Полученный раствор сульфата цинка затем обрабатывают сероводородом из раствора: ZnSO4 + H2S => ZnS + H2SO4 В результате этой реакции происходит осаждение сульфида цинка, который затем выделяют в виде порошка. |
|
12. Химическая термодинамика. Предмет и методы. Перечень вопросов на который позволяет ответить химическая термодинамика.
ХТД – раздел физической химии. Предмет ХТД – энергетика химических и фазовых превращений. ХТД ограничивается рассмотрением состояния равновесия и оценивает возможности установления этого равновесия.
Методы ХТД: 1)расчетный метод функций состояния 2) экспериментальный, колориметрический
ХТД позволяет не проводя никаких экспериментальных исследований чисто расчетным путем определить: -кол-во теплоты, которое выделится или поглотится в ходе протекания любой химической реакции - будет или не будет данная реакция или процесс протекать в данном направлении - при каком соотношении концентраций исходных веществ и конечных продуктов установится химическое равновесие - как влияют внешние условия на возможность протекания реакции и параметры равновесия (p, V, T)
|
|
|
13. Химическая термодинамика. Основные понятия. Понятие функции состояния.
ХТД – раздел физической химии. Предмет ХТД – энергетика химических и фазовых превращений. ХТД ограничивается рассмотрением состояния равновесия и оценивает возможности установления этого равновесия.
Понятия:
Система – это тело или группа находящихся во взаимодействии тел, мысленно или с помощью поверхностей раздела обособленных от окружающей среды.
Изолированной системой называют такую систему, которая не может обмениваться с внешней средой ни веществом, ни энергией. Запрет обмена энергией касается как теплоты, так и любого вида работы.
Состояние системы описывается набором термодинамических параметров, макроскопических величин, выражающих свойства большого числа молекул. Параметры, которые можно измерить – Т, P, V, заряд e – внешние параметры. Другие параметры могут быть рассчитаны с помощью внешних параметров, они – внутренние параметры или функции состояния, их выражают через внешние параметры. Пример – внутренняя энергия системы U.
Внутренняя энергия – сумма потенциальной энергии взаимодействия всех частиц тела между собой и кинетической энергии их движения. Ее, как и другие функции состояния, в ХТД обычно относят к одному молю вещества. |
|
|
14. Определение теплового эффекта химической реакции Тепловой эффект химической реакции – кол-во теплоты, которое выделяется или поглощается в результате необратимо протекающей реакции при постоянном V или P и при условии, что продукты реакции имеют ту же температуру, что и исходные вещества. Определенный таким образом тепловой эффект является ФС
Два типа тепловых эффектов имеют важную роль в химической термодинамике –тепловой эффект образования (теплота образования химического соединения) -тепловой эффект сгорания (теплота сгорания) химического соединения
В таблицах термодинамических величин приводят как правило только стандартные тепловые эффекты (для веществ в стандартном состоянии) сгорания и образования. Тепловые эффекты реакций при температурах, отличных от стандартных рассчитываются методом уравнения Кирхгофа или методом циклов. См билет 18 |
1. Тепловой эффект образования химического соединения равен тепловому эффекту разложения этого соединения с противоположным знаком ΔHобр= - ΔHразл
2. Тепловой эффект реакции ΔHr
m и n – стеклометрические коэффициенты (стехиометрические наверное =)) )
3. Тепловой эффект реакции ΔHr
В таблицах термодинамических величин приводят как правило только стандартные тепловые эффекты сгорания и образования. Тепловые эффекты реакций при температурах, отличных от стандартных рассчитываются методом уравнения Кирхгофа или методом циклов.
|
|
15. Первый закон термодинамики. Энтальпия. Частный случай закона сохранения энергии. а)Внутренняя энергия изолированной системы постоянна. U=conts, dU=0 б)Все виды энергии переходят друг в друга в строго эквивалентных отношениях
δQ=du+SW – работа не является функцией состояния
Теплота, поддерживаемая в системе идет на увеличение внутренней энергии системы и на совершение системой работы δ – не ФС, d – не ФС δW=pΔV δQ=dU+ pΔV
1. Рассмотрим систему при V=const V=const ΔV=0 δQ=dU+ (pΔV)=0 δQ=dU dU – теплоте, V=const В системе при V=const теплота приобретает свойства функции состояния QV – ФС 2. При p=const δQ=dU+ pΔV=ΔU+ pΔV=U2-U1+pV2-pV1=(U2pV2)-(U1+pV1)=H2-H1=ΔH – энтальпия δQ= ΔH Из этого выражения видно, что теплота при постоянном давлении приобретает свойства ФС Таким образом если химическая реакция протекает при постоянном объеме или давлении, то теплота, которая выделяется или поглощается при протекании реакции является ФС
Энтальпия – ФС H=U+pV [кДж/моль] Характеристическая функция H=U+pV называется энтальпией
|
|
|
17. Первый закон термодинамики. Закон Гесса. Частный случай закона сохранения энергии. а)Внутренняя энергия изолированной системы постоянна. U=conts, dU=0 б)Все виды энергии переходят друг в друга в строго эквивалентных отношениях
δQ=du+SW – работа не является функцией состояния
Теплота, поддерживаемая в системе идет на увеличение внутренней энергии системы и на совершение системой работы δ – не ФС, d – не(?) ФС δW=pΔV δQ=dU+ pΔV
1. Рассмотрим систему при V=const V=const ΔV=0 δQ=dU+ (pΔV); (pΔV)=0 δQ=dU dU – ФС, V=const В системе при V=const теплота приобретает свойства функции состояния QV – ФС 2. При p=const δQ=dU+ pΔV=ΔU+ pΔV=U2-U1+pV2-pV1=(U2+pV2)-(U1+pV1)=H2-H1=ΔH – энтальпия δQ= ΔH Из этого выражения видно, что теплота при постоянном давлении приобретает свойства ФС Таким образом если химическая реакция протекает при постоянном объеме или давлении, то теплота, которая выделяется или поглощается при протекании реакции является ФС
|
Закон Гесса. Если из заданных исходных веществ можно получить конечные продукты различными путями, то суммарных тепловой эффект на одном пути равен суммарному тепловому эффекту на любом другом пути.
энтальпийная диаграмма
ΔH1= ΔH2+ ΔH3= ΔH4+ ΔH5+ ΔH6 ΔH1=-110.6 кДж/моль C+1/2O2=CO ΔH2=-282.83 CO+1/2O2=CO2 ΔH3=-393.43 C+O2=CO2 ΔH1+ ΔH2= ΔH3
|
|
18. Следствия из закона Гесса. Вычисление тепловых эффектов химических реакций. Тепловой эффект – кол-во теплоты, выделившейся или поглощенной в результате полного превращения исходных веществ в продукты реакции при постоянном объеме или давлении и при соблюдении условий, что температура исходных веществ и продуктов реакции одинакова, и в системе в процессе реакции никакой работы, кроме расширения не происходит.
1. Тепловой эффект образования химического соединения равен тепловому эффекту разложения этого соединения с противоположным знаком ΔHобр= - ΔHразл
2. Тепловой эффект реакции ΔHr
m и n – стеклометрические коэффициенты (стехиометрические наверное =)) )
3. Тепловой эффект реакции ΔHr
В таблицах термодинамических величин приводят как правило только стандартные тепловые эффекты сгорания и образования. Тепловые эффекты реакций при температурах, отличных от стандартных рассчитываются методом уравнения Кирхгофа или методом циклов.
|
Тепловой эффект химической реакции определяется только природой исходных веществ и продуктов реакции и не зависит от протекания промежуточных реакций. |
|
19. Второй закон термодинамики. Энтропия. Ее изменение как критерий протекания процессов в изолированных процессах 2-й закон термодинамики вводит в рассмотрение новую ф-цию состояния – энтропию. S [кДж/моль*К] S=kln(W), где W – НЕ работа, W – термодинамическая вероятность системы
W – термодинамическая вероятность системы NA=6.023*1023 1/моль
W – это число микросостояний, с помощью которых может быть реализовано данное макросостояние системы. Smin в холоде, с увеличением температуры, растет энтропия. Sгаза>Sжидкости
Энтропия – степень беспорядка системы (полный порядок, когда энтропия=0)
|
Формулировки 2ого закона.
Следствие
В изолированной системе самопроизвольно могут протекать процессы, сопровождающиеся увеличением энтропии
Предел протекания таких процессов – минимальное(???) значение S При абсолютном нуле – энтропия =0 (3й закон термодинамики)
|
|
20. Второй закон термодинамики. Энтропия как степень беспорядка системы. 2-й закон термодинамики вводит в рассмотрение новую ф-цию состояния – энтропию. S [кДж/моль*К] S=kln(W) W – НЕ работа
W – термодинамическая вероятность системы NA=6.023*1023 1/моль
W – это число микросостояний, с помощью которых может быть реализовано данное макросостояние системы. Smin в холоде, с увеличением температуры, растет энтропия. Sгаза>Sжидкости
Энтропия – степень беспорядка системы (полный порядок, когда энтропия=0)
|
В изолированной системе самопроизвольно могут протекать процессы, сопровождающиеся увеличением энтропии
Предел протекания таких процессов – минимальное значение S При абсолютном нуле – энтропия =0 (3й закон термодинамики)
Формулировки 2ого закона.
|
|
21. Энергия Гельмгольца. Ее изменение как критерий протекания процессов при V=const и T=const ΔF=ΔU-TΔs – свободная энергия Гельмгольца (V=const) Если процесс протекает при V=const и T=const F=U-Ts dF=DU-TdS-SdT dF=dU-TdS
δQ=dU+δW (W=pdV) (1й закон) δQ≤Tds (2й закон)
Объединяя выражения получаем: TdS≥dU+pdV
dA≤0 В
|
|
|
22. Энергия Гиббса. Ее изменение как критерий протекания процессов при P=const и T=const
ΔG=ΔH-TΔs – свободная энергия Гиббса (p=const)
G=H-TS=U+pV-TS dG=dU+pdV+Vdp-TdS-SdT dG=dU+pdV-TdS
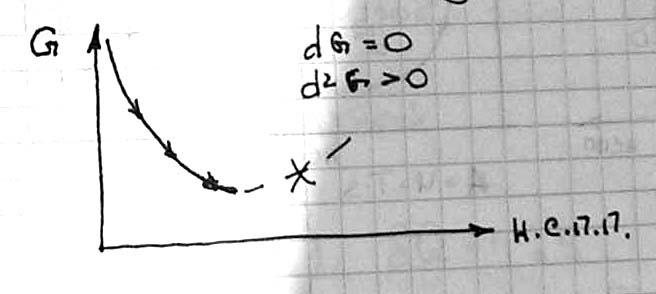
Совместно решая 1-3 и исключая dH, учитывая: dT=0, dV=0, получаем dG≤0 В системах при P=const и T=const самопроизвольно протекают процессы, сопровождающиеся уменьшением энергии Гиббса. Предел протекания этих процессов – минимальное значение G Т.е. если ΔG>0 – прямая реакция невозможна ΔG<0 – прямая реакция возможна ΔG=0 – реакция обратима
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
29. Диффузия. Первый и второй законы Фика. Энергия активации диффузии.
Механизмы диффузии: 1. Обменный/Кольцевой.
Непосредственно обменивается местами с другим атомом. 2. Междоузельный.
- перемещение в междоузелье. - вытеснение соседнего атома из нормального положения. (Щелевой механизм.) - путем движения сжатых в некотором направлении атомов. 3. Вакансионный.
Движение в соседнее свободное место. |
4. Субграничный.
Вдоль дислокационных трубок, образующихся в результате встречи моноугловых мозаик. 5. релаксационный механизм.
Перемещается в жидкоподобной области, которая сама движется амебообразно в кристаллической решетки. Разновидность вакансионного механизма
Самодиффузия – перемещение атомов основного материала в собственной кристаллической решетке. Основной механизм – вакнсионный. Энергия активации – работа которая требуется для того, чтобы вырвать атом из нормального положения. Гетеродиффузия – перемещение инородных атомов в кресталлической решетке. Происходит самопроизвольно от мест высокой концентрации в места низкой концентрации, т.к. состояние с неравномерной концентрацией обладает большей энергией чем с равномерной.
|



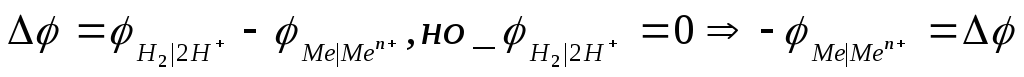
 альванический
элемент Якоби-Даниэля состоит из двух
полуэлементов соединенных металлических
проводником.
альванический
элемент Якоби-Даниэля состоит из двух
полуэлементов соединенных металлических
проводником.









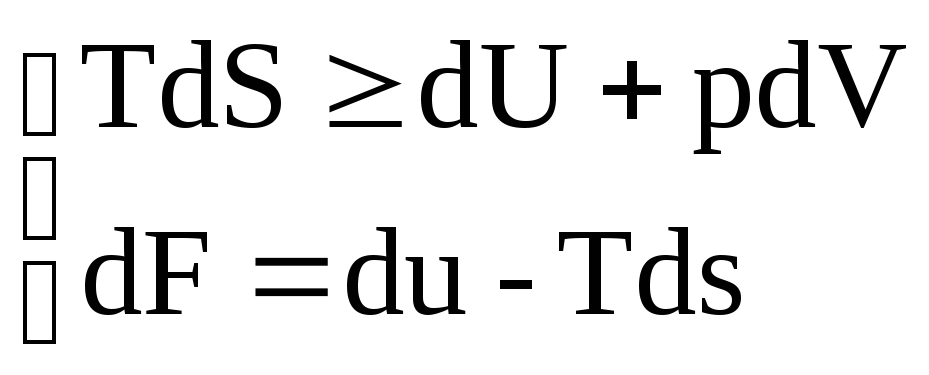
 системах при V=const
и T=const
самопроизвольно протекают процессы,
сопровождающиеся уменьшением энергии
Гельмгольца
системах при V=const
и T=const
самопроизвольно протекают процессы,
сопровождающиеся уменьшением энергии
Гельмгольца