
Ацетанілід Ацет-м-толуідид
За звичайних умов деякі аміди мурашиної кислоти (НС(О)-NH2, HC(O)-NH-CH3, HC(O)-N(CH3)2) є рідинами, інші аміди – кристалічні речовини з чіткими температурами плавлення
Високі температури плавлення та кипіння появнюються міжмолекулярними водневими звязками між атомом оксигену карбонільної групи (С=О) однієї молекули і атомо Гідрогену аміногрупи (NH2) іншої молекули. Водневі звязки сприяють утворенню асоціатів, які можуть існувати у лінійній формі чи у формі циклічних димерів:
CH3 CH3


CH3
O H CH3
CH3
O H CH3
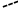
 Н
С
H C C
N
Н
С
H C C
N
N O N O

N
C
N
C
CH3 CH3 CH3 H O CH3
Лінійний асоціат Димерний асоіціат
N-метилацетаміду N-метилацетаміду
Дизаміщені аміди утворюються асоціати не за рахунок водневих звязків, які в них не можливі, а завдяки диполь – дипольній взаємодії двох полярних молекул:
 СН3
СН3
СН3
СН3
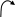 -
+
-
+
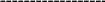
 O
N
:
O
N
:
C CH
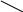

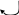
 +
-
+
-
 :
N O
:
N O
CH3 CH3
Димерний асоціат N,N-диметилформаміду
Нижчі аміни добре розчинні у воді, а із збільшенням молярної маси їх розчинність різко зменшується.
Способи одержання.
Ацилювання амоніаку і амінів галогенангідридами. Реакція належить до сильно екзотерміних процесів, тому проводиться при охолоджуванні реакційної суміші (-100С) у слабколужному середовищі, щоб уникнути гідролізу галогенангідридів:
O -100C O
СН3-С + 2NH3 ------------ CH3-C + NH4Cl
Cl OH- NH2
Ацетилхлорид Ацетиамід
O + O
СН3-С + [C2H5NH3]Cl- + NaOH --- CH3-C + NaBr + NaCl +H2O
Br NHC2H5
Ацетилбромід Хлорид N-Етилацетамід
етиламонію
Ацилювання амоніаку і амінів ангідридами
О
СН3-С
О + ------- + CH3COOH
СН3-С
О
Оцтовий ангідрид n-Гідроксианілін n-Гідроксиацетанілін
(парацеталом)
Амоноліз естерів внаслідок їх взаємодії з амоніаком чи амідами:
O O
 СН3-СН2-С
+
NH3
---
CH3-CH2-C
+ CH3OH
СН3-СН2-С
+
NH3
---
CH3-CH2-C
+ CH3OH
O-CH3 NH2
Метилпропіонат Пропанамід
Амоголіз кетенів – сполук, що містять группу >C=C=O, які можна вважати внутрішніми ангідридами карбонових кислот:
 CH3
CH3
O
CH3
CH3
O
C=C=O + NH3 ----- CH-C
CH3 CH3 NH2
Диметилкетен Ізобутирамід
Неповний гідроліз нітрилів у лужному середовищі у присутності пероксидів:
500C
+ Н2О ---------------------
KOH, H2O2
Бензонітрил Бензамід
Хімічні властивості зумовлюються їх електронною будовою, яка значною мірою нагадує будову карбоксильної групи у кислотах. Амідна група уявляє собою, р, - спряжену систему за рахунок неподіленої пари р-електронів атома Нітрогену і -електронів подвійного звязку С=О.
Кислотно-основні властивості виявляються дуже слабко. Вони повязані із здатністю атома Оксигену приєднувати протон (+Н+) при взаємодії з сильними мінеральними кислотами, а також із здатністю незаміщеної аміногрупи відщеплювати протон (-Н+) під впливом сильної основи. Однак, слід ще раз наголосити, що і кислотні (-Н+), і основні (+Н+) властивості амідів надзвичайно слабкі, тому вони не мають самостійного значення, але сприяють приоритетному напрямленню реакцій залежно від природи реагентів і характеру середовища.


 +
+
O +H+ OH + OH

 R-C
R-C
R-C
R-C
R-C
R-C
 :
NH2
NH2
NH2
:
NH2
NH2
NH2
Гідроліз амідів проходить у кислому чи лужному середовищі при значно жорсткіших умовах, ніж гідроліз естерів. При цьому як кислотний, так і лужний гідроліз належать до необоротних процесів.
O O
R-C + HCl + H2O ---- R-C + NH4Cl
NH2 OH
Амід Карбонова кислота
O O + -
R-C + HCl + H2O ---- R-C + R1-NH2Cl
NHR1 OH
N-Заміщений амід Алкилхлорид амонію
O O
R-C + NaOH ---- R-C + NH3
NH2 ONa
Амід Карбоксилат натрію
O O
R-C + NaOH ---- R-C + NH2R1
NHR1 ONa
N-Заміщений амід
Взаємодія з азотистою кислотою приводить до утворення карбонової кислоти через проміжну нітрозосполуку (тобто сполуку, що містить нітрозогрупу – NO):
 O
O
O
O
O
O
R-C + HNO2 ---- R-C ---- R-C + N2 + H2O
NH2 NH-NO OH
Амід N-Нітрозоамід Кислота
Ацилювання амідів ангідридами чи галогенангідридами при нагріванні незаміщених чи N-монозаміщених амідів з ангідридами і галогенангідридами є способи одержання імідів – диацильних похідних амоніаку R-C(O)-NH-C(O)-R1:
O
O O R-C
R-C + R1-C -- NH + HCl
NH2 Cl R-C
O
Амід Галогенангідрид Диацилімід
Іміди дикарбонових кислот утворюються при їх взаємодії з амоніаком:
+ NH3 ------ + 2H2O
Фталева кислота Фиалімід
О О

 СН2—С
СН2—С
СН2—С
СН2—С
OH
OH + NH3 ---- NH + 2H2O
CH2—C
О CH2—C
O
Янтарна кислдота Сукцинімід
(імід янтарної кислоти)
Алкілювання амідів може проходити як по атому Оксигену, внаслідок чого утворюються іміноестери, так і по атому Нітрогену з утворенням N-заміщених амідів:
N- алкілювання O
 -----------------------
R-C + HBr
-----------------------
R-C + HBr
O NH-R1
R-C + R1-Br ------- N-Заміщений амід
NH2 О-алкілювання NH
--------------------- R-C + HBr
OR1
Іміностер
Галогенування при дії галогенів у лужному середовищі (чи гіпогалогенітів, наприклад NaBrO) за умов низьких температур, при якому атом Н в аміногрупі первинних и вторинних амідів заміщується на атом галогену.
O 00C O
CH3-C + Br2 + KOH --------- CH3-C +KBr + H2O
NH2 NH-Br
Ацетоамід N-Бромоацетамід
O O
 C
C
C
C
CH2 00 CH2
NH + Br2 + KOH --- N-Br + KBr + H2O
CH2 CH2
C C
O O
Сукцинімід N-Бромосуксинамід
Галогенациламіди мають велике значення в органічному синтезі, їх застосовують як окисники та галогенуючі реагенти, особливо N-бромоацетамід і N-бромосукцинімід.
Дегідратація, внаслідок якої аміди під дією водовідщеплююючих реагентів перетворюються в нітрили.
O
3R-C + P2O5 ----- 3R-CN + 2H3PO4
NH2
Амід Нітрил
Відновлення амідів проходить складніше, ніж відновлення карбонільних сполук і естерів. Залежно від відновника аміди можуть відновлюватися до амінів (під дією LiAlH4) чи до альдегідів (натрієм у рідкому амоніаку):
О
R-C + 2H2 -------------- R-CH2-NH2 + H2O
NH2 LiAlH4 Первинний амін
О
R-C + 2H2 -------------- R-CH2-NH-R1 + H2O
NHR1 LiAlH4 Вторинний амін
 О
R1
О
R1
R-C + 2H2 -------------- R-CH2-N + H2O
NR1R2 R2
Третинний амін
О O
R-C + 2H2 -------------- R-CH2-N + R1-NH-R2
NR1R2 Na, NH3 (р) H
N,N-Дизаміщений Альдегід
амід
