
- •1 .Основи гідрокінетики
- •2.Газоочищеня
- •4. Перемішування
- •5.Псевдозрідження
- •6.Масообмін через напівпроникні перетинки (мембрани)
- •7.Основи масопереносу
- •8.Абсорбція
- •9.Перегонка рідин
- •10. Екстракція
- •11.Подрібнення
- •1 .Основи гідрокінетики
- •1.1 .Загальні відомості
- •1.2.Класифікація рідких неоднорідних систем та гідромеханічних процесів.
- •1.3. Методи очищення неоднорідних систем
- •2. Газоочищення.
- •2.1. Диференційне рівняння осадження частинок під дією сили тяжіння
- •2.2 Розв'язок диференційного рівняння з метою визначення швидкості осадження
- •2.3.Визначеннч швидкості осадження частинок пі дією сили тяжіння
- •2.4.Гравітаційне осадження . Визначення продуктивності газового відстійника
- •2.5. Розділення сумішей в полі відцентрових сил.
- •1.9. Циклонний процес.
- •Розрахунок циклонів
- •1.10. Осадження під дією електричного поля
- •2.Фільтрування Вступ
- •2.1 Кінетика фільтрування.
- •Виведення рівняння Нав'є – Стокса .
- •Отримання основного рівняння фільтрації
- •2.2.Основне рівняння фільтрації
- •Промивка осаду
- •3. Центрифугування
- •3.2. Розрахунок відстойної центрифуги
- •З.З.Центробіжне фільтрування
- •4. Перемішування
- •4.1. Перемішування в рідкій фазі
- •5.Псевдозріження твердого зернистого матеріалу
- •5.1. Гідродинамічна суть процесу псевдозрідження
- •5.2. Визначення еквівалентного діаметра каналу в зернистому слою. Гідравлічний опір зернистого слою
- •5.3. Визначення швидкості початку псевдозрідження
- •6. Масообмін через напівпроникні перетинки (мембрани)
- •6.1. Найважливіші мембранні методи та межі їх застосування.
- •6.2. Функціональні характеристики мембран.
- •6.3. Кінетика процесів мембранного розділення сумішей.
- •7. Основи масопереносу
- •7.1. Загальні відомості про масообмінні процеси.
- •7.2. Основне рівняння масопередачі
- •7.3. Рівняння і лінії рівноваги
- •7.4. Матеріальний баланс масообмінних процесів.
- •7.5. Рушійна сила масообмінних процесів
- •7.6. Модифіковане рівняння масопередачі.
- •7.10. Визначення числа одиниць переносу
- •7.11.Основні закони масопередачі
- •Диференційне рівняння масовіддачі ( конвективної дифузії)
- •7.12.Основи розрахунку масообмінних апаратів.
- •8.1 Рівновага в процесах абсорбції.
- •8.2. Кінетика процесу абсорбції
- •Абсорбція, що супроводжується хімічною реакцією
- •8.4. Тепловий баланс і температура абсорбенту.
- •8.5. Принципіальні схеми абсорбції
- •9.Перегонка рідин.
- •9.1. Характеристики двофазних систем рідина - пар.
- •9.2. Ректифікація
- •9.3. Аналіз роботи ректифікаційних колон
- •Матеріальний баланс ректифікаційних колон
- •Рівняння робочих ліній
- •Побудова робочих ліній на діаграмі у-х
- •10. Екстракція
- •10.1. Рівновага в процесах екстракції
- •10.2 Діаграма х-у
- •10.3. Трикутна діаграма
- •10.4. Зображення процесів розведення на трикутній діаграмі
- •10.5. Процеси змішування на трикутній діаграмі. Правило ричага
- •10.6. Крива рівноваги на трикутній діаграмі
- •10.7.3Находження хорд рівноваги і критичної точки
- •10.8. Види трикутних діаграм
- •10.9. Вплив температури на рівновагу
- •10.10. Матеріальний баланс екстракції
- •10.11. Кінетика екстракції
- •10.12. Принципові схеми екстракції
- •11.Подрібнення
- •11.2. Щокова дробарка. Визначення кута захвата
10.7.3Находження хорд рівноваги і критичної точки
Як видно з рис. 10.7.1, на трикутній діаграмі нанесено, згідно експериментальними даним, невелике число хорд рівноваги. Але в розрахунковій практиці виникає необхідність побудови всередині гетерогенної області будь-яку хорду рівноваги. З цією метою на трикутну діаграму наносять так звану з'єднуючу лінію, як це виконано на рис. 10.7.1.
Для побудови з'єднуючої лінії використовують точки Е і R, Е1 і R1, Е2 і R2 на обох гілках ЕК і як бінодальної кривої ЕК, яка характеризує рівноважні склади.
Через точки Е, Е1, Е2 ... паралельно сторонам MG і ML діаграми проводять лінії побудови до їх перетину в точках С, С1, С2, .... як це показано на рис. 10.7.1. Проводячи через точки перетину плавну криву, знайдемо, з'єднуючу лінію СС1С2...К, котра перетинає лінію рівноваги в критичній точці змішання К.
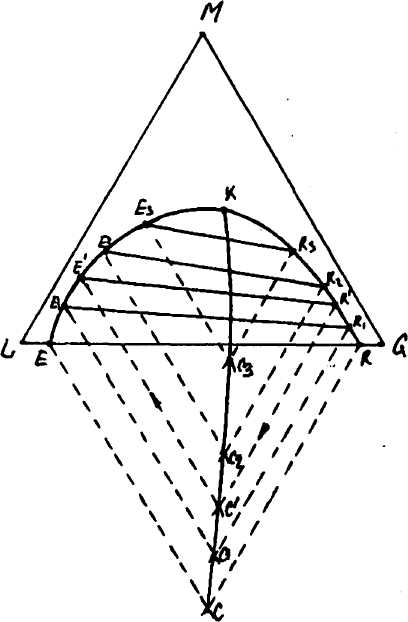
Рис. 10.7.1. Інтерполяція хорд рівноваги.
Для характеристики будь-якої хорди рівноваги, яка проходить через точку R`, на правій гілці рівноважної кривої необхідно провести лінію побудови R`C`, паралельну стороні ML діаграми, до перетину зі з'єднуючою лінією в точці С` Потім з точки С` потрібно провести другу лінію побудови С`Е` паралельно стороні MG діаграми до перетину з лівою гілкою рівноважної кривої в точці Е'. З'єднавши R` і E` прямою лінією, отримаємо шукану хорду рівноваги R'E'. Знаходження хорд рівноваги з допомогою з'єднуючої лінії називається інтерполяцією хорд рівноваги.
10.8. Види трикутних діаграм
Крім типової діаграми рівноваги, яка приведена на рис. 10.8.1 зустрічаються також і інші види трикутних діаграм з двома зонами обмеженої розчинності (рис.10.8.1,а), причому ці дві зони можуть бути злитими в одну область обмеженої розчинності (рис. 10.8.1,б).
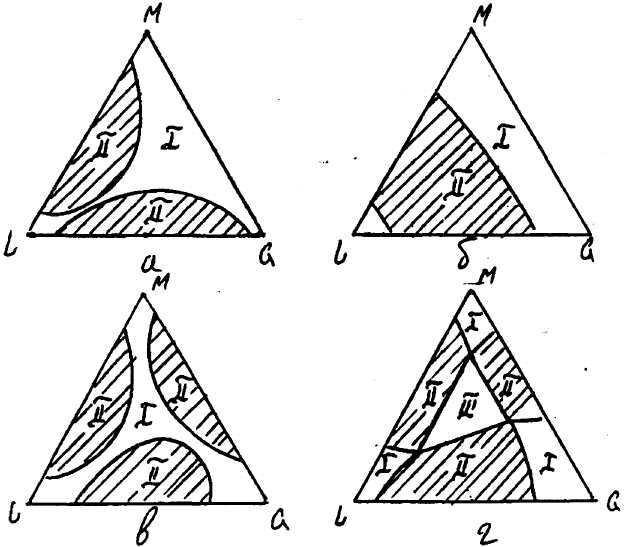
Рис. 10.8.1. Типи трикутних діаграм з двома (а,б) і трьома (в,г) областями обмеженої розчинності
[римськими цифрами позначені області з одною (І), двома (II) і трьома (III) рідкими фазами].
Можливі випадки, коли всі три компонента виявляють часткову взаємну розчинність (рис. 10.8.1,в), при чому ці три зони можуть бути з'єднані одна з одною, утворюючи систему, яку представлено на рис.10.8.1,г. На рис. 10.8.1 показано області однорідних розчинів (І), області з двома (II) і трьома (III) фазами.
10.9. Вплив температури на рівновагу
Всі вище наведені діаграми рівноваги складені для умов постійної температури. Тому криві рівноваги називаються також ізотермами.
В більшості випадків взаємна розчинність компонентів зі збільшенням температури підвищується і область існування гетерогенних двофазних систем зменшується. На рис. 10.9.1 приведено криві рівноваги при різних температурах, при чому t1<t2<t3<t4.
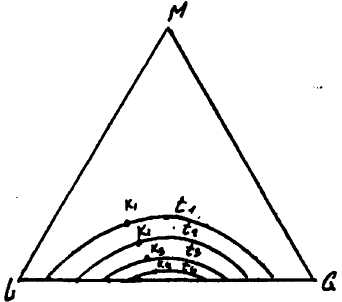
Рис. 10.9.1. Вплив температури на положення кривої рівноваги при t1<t2<t3<t4.
Зміна розчинності малорозчинних рідин, викликана зміною зовнішнього тиску, досить невелика і в більшості випадків нею можна знехтувати. Тому положення лінії рівноваги на трикутній діаграмі зі зміною зовнішнього тиску майже не змінюється, діаграма рівноваги зберігає вигляд для значної області тиску.
