
- •1 .Основи гідрокінетики
- •2.Газоочищеня
- •4. Перемішування
- •5.Псевдозрідження
- •6.Масообмін через напівпроникні перетинки (мембрани)
- •7.Основи масопереносу
- •8.Абсорбція
- •9.Перегонка рідин
- •10. Екстракція
- •11.Подрібнення
- •1 .Основи гідрокінетики
- •1.1 .Загальні відомості
- •1.2.Класифікація рідких неоднорідних систем та гідромеханічних процесів.
- •1.3. Методи очищення неоднорідних систем
- •2. Газоочищення.
- •2.1. Диференційне рівняння осадження частинок під дією сили тяжіння
- •2.2 Розв'язок диференційного рівняння з метою визначення швидкості осадження
- •2.3.Визначеннч швидкості осадження частинок пі дією сили тяжіння
- •2.4.Гравітаційне осадження . Визначення продуктивності газового відстійника
- •2.5. Розділення сумішей в полі відцентрових сил.
- •1.9. Циклонний процес.
- •Розрахунок циклонів
- •1.10. Осадження під дією електричного поля
- •2.Фільтрування Вступ
- •2.1 Кінетика фільтрування.
- •Виведення рівняння Нав'є – Стокса .
- •Отримання основного рівняння фільтрації
- •2.2.Основне рівняння фільтрації
- •Промивка осаду
- •3. Центрифугування
- •3.2. Розрахунок відстойної центрифуги
- •З.З.Центробіжне фільтрування
- •4. Перемішування
- •4.1. Перемішування в рідкій фазі
- •5.Псевдозріження твердого зернистого матеріалу
- •5.1. Гідродинамічна суть процесу псевдозрідження
- •5.2. Визначення еквівалентного діаметра каналу в зернистому слою. Гідравлічний опір зернистого слою
- •5.3. Визначення швидкості початку псевдозрідження
- •6. Масообмін через напівпроникні перетинки (мембрани)
- •6.1. Найважливіші мембранні методи та межі їх застосування.
- •6.2. Функціональні характеристики мембран.
- •6.3. Кінетика процесів мембранного розділення сумішей.
- •7. Основи масопереносу
- •7.1. Загальні відомості про масообмінні процеси.
- •7.2. Основне рівняння масопередачі
- •7.3. Рівняння і лінії рівноваги
- •7.4. Матеріальний баланс масообмінних процесів.
- •7.5. Рушійна сила масообмінних процесів
- •7.6. Модифіковане рівняння масопередачі.
- •7.10. Визначення числа одиниць переносу
- •7.11.Основні закони масопередачі
- •Диференційне рівняння масовіддачі ( конвективної дифузії)
- •7.12.Основи розрахунку масообмінних апаратів.
- •8.1 Рівновага в процесах абсорбції.
- •8.2. Кінетика процесу абсорбції
- •Абсорбція, що супроводжується хімічною реакцією
- •8.4. Тепловий баланс і температура абсорбенту.
- •8.5. Принципіальні схеми абсорбції
- •9.Перегонка рідин.
- •9.1. Характеристики двофазних систем рідина - пар.
- •9.2. Ректифікація
- •9.3. Аналіз роботи ректифікаційних колон
- •Матеріальний баланс ректифікаційних колон
- •Рівняння робочих ліній
- •Побудова робочих ліній на діаграмі у-х
- •10. Екстракція
- •10.1. Рівновага в процесах екстракції
- •10.2 Діаграма х-у
- •10.3. Трикутна діаграма
- •10.4. Зображення процесів розведення на трикутній діаграмі
- •10.5. Процеси змішування на трикутній діаграмі. Правило ричага
- •10.6. Крива рівноваги на трикутній діаграмі
- •10.7.3Находження хорд рівноваги і критичної точки
- •10.8. Види трикутних діаграм
- •10.9. Вплив температури на рівновагу
- •10.10. Матеріальний баланс екстракції
- •10.11. Кінетика екстракції
- •10.12. Принципові схеми екстракції
- •11.Подрібнення
- •11.2. Щокова дробарка. Визначення кута захвата
10.4. Зображення процесів розведення на трикутній діаграмі
На трикутній діаграмі можна зобразити процеси зміни складу трикомпонентної суміші. Якщо, наприклад, до розчину, який відповідає точці N (рис.10.4.1,а), прибавляти компонент М, то співвідношення вмісту компонентів G і L не зміниться. Точки, що відповідають цим розчинам, знаходяться на прямій NM і тим ближче до вершини М трикутника, чим багатше стає суміш компонентом М.
Якщо ж вилучати компонент М з суміші N (або розводити N двокомпонентною сумішшю постійного складу), то її складам будуть відповідати точки, які лежать на прямій NP, і чим менше компонента М в суміші, тим ближче склад до сторони LG трикутника .В сумішах всіх складів, які відповідають точкам, що лежать на прямій РМ, при зміні вмісту компонента М відношення кількостей інших двох компонентів (G і L) буде залишатись постійними.
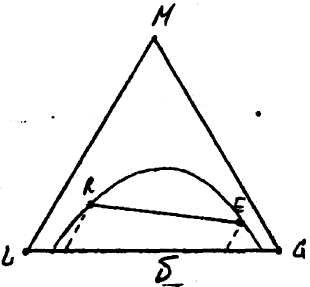
Розбавлення суміші N розчинником G характеризує лінія NG (рис. 10.4.1 ,а).
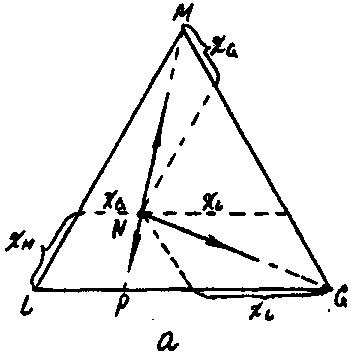
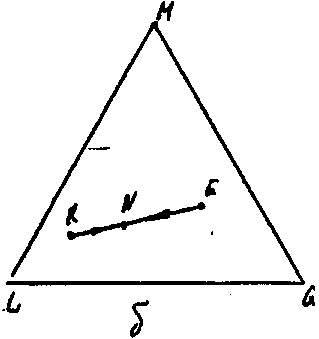
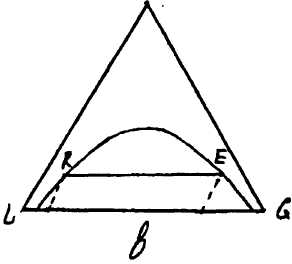
Рис. 10.4.1 Зображення процесів розбавлення (а) і змішування (б) на трикутній діаграмі.
10.5. Процеси змішування на трикутній діаграмі. Правило ричага
При змішуванні двох трикомпонентних розчинів складів R і Е (рис. 10.4.1,б) утворюється потрійна суміш, склад котрої характеризується точкою N, яка лежить на прямій RE, яка з'єднує вихідні склади. Положення точки N на прямій знаходять по правилу ричага, якщо відомо кількості взятих розчинів R і Е
(кількість R)/( кількість E) = EN/RN (10.5.1)
Звідки випливає, що якщо суміш N будь-яким методом розкласти на дві фракції R і Е, то точки R, Е і N, які відповідають цим трьом сумішам, повинні лежать на прямій RNE. Якщо відомо кількість суміші N, її склад і склади фракцій після розділення суміші, то легко знайти кількість цих фракцій по виразам:
(кількість R)/(кількість N) = EN/(RN+EN) = EN/RE (10.5.2)
(кількість Е)/( кількість N) = RN/(RN+EN) = RN/RE (10.5.3)
10.6. Крива рівноваги на трикутній діаграмі
Трикутна діаграма (рис.10.6.1) може бути використана для зображення рівноваги в потрійних системах координат рідина - речовини, що розподіляється - рідина. Аби отримати уявлення про рівновагу в потрійних системах, розглянемо процес додавання речовини М, що розподіляється, до гетерогенної суміші двох розчинників L і G. Нехай речовина М, що розглядається, необмежено розчиняється в обох розчинниках L і G, а самі розчинники L і G мають обмежену взаємну розчинність.
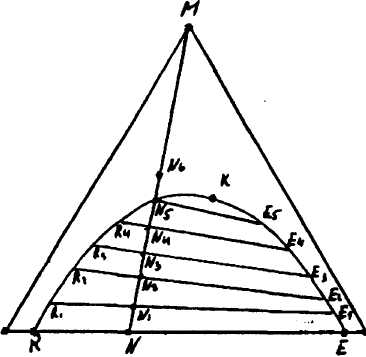
Рис. 10.6.1. Крива рівноваги на трикутній діаграмі.
З трикутної діаграми, яку представлено на рис.10.6.1, видно, що якщо М і L а також М і G утворюють однорідні двокомпонентні розчини, склад котрих характеризується точками на сторонах діаграм LМ і GM, то розчинним L і G утворюють однорідні розчини лише на невеликих ділянках LR і EG. Будь-яка суміш розчинників на ділянці RE розшаровується на два однорідних двокомпонентних насичених розчина R (насичений розчин G в L) і Е (насичений розчин L в G). Кількість насичених розчинів в кожному з двох шарів, що утворилися, залежить від положення точки N , яка виражає середній склад двофазної системи, і може бути визначена по правилу ричага з виразів (10.5.1) - (10.5.3).
При додаванні речовини М, що розподіляється, в суміш склaду N отримуємо потрійну суміш, склад котрої характеризується точкою N1, яка лежить на прямій змішyвання NM. Суміш складу N1 розшаровується на дві фази з рівноважними складами R1 (фаза розчинника L) і Е1 (фаза розчинника G) в кількісному співвідношенні E1N1:R1N1.
При додаванні в суміш наступних порцій М2, М3,... отримаємо ряд потрійних сумішей складу N2, N3, .... котрі, як видно в попередньому випадку, розшаровуються на рівноважні потрійні суміші складу R2 і Е2, R3 і Е3 і т.д. Як видно з діаграми, змінюються і вагові співвідношення рівноважних розчинів до моменту, коли одна з фаз щезає (в нашому випадку при N5). При ще більшому розвeденні компонентом, що розподіляється, маємо лише однорідні потрійні розчини складу N6 і інші.
З'єднавши R1 і Е1, R2 і E2, ... лініями, отримаємо хорди рівноваги R1 E1, R2 Е2 які з'єднують на діаграмі рівноважні склади. Хорди рівноваги, зменшуючись, сходяться в точці К, яка зветься критичною.
З'єднавши точки, які відповідають рівноважним складам, плавною кривою RR1R2 ... К ... Е2Е1Е, отримаємо криву рівноваги , або так звану бінодальну криву, одна гілка RK котрої характеризує рівноважні склади фази розчинника L, а друга ЕК - рівноважні склади фази розчинника G.
Бінодальна крива на трикутній діаграмі обмежує площу, яка відповідає двофазним сумішам; площа діаграми поза кривою відповідає однофазним розчинам. Для процесу екстракції цікавість являє лише зона двофазних розчинів.
По трикутній діаграмі легко знайти коефіцієнт розподілення ψ для будь-якої пари рівноважних розчинів. Так як для двох розчинів R і Ε (рис. 10.6.2) коефіцієнт розподілення ψ дорівнює:
ψ = (концентрація М в фазі F)/( концентрація М в фазі R) (10.6.1)
причому величина ψ може бути більше одиниці (рис. 10.6.2,а), менше одиниці (рис. 10.6.2,б) або рівна одиниці (рис. 10.6.2,в).
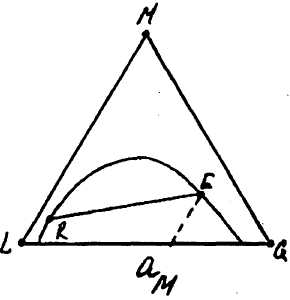
ψ>1 ψ<1 ψ=1
Рис. 10.6.2. До розрахунку коефіцієнта розподілення.
Нахил хорди рівноваги визначається природою компонентів і складом фаз.
