
- •1 .Основи гідрокінетики
- •2.Газоочищеня
- •4. Перемішування
- •5.Псевдозрідження
- •6.Масообмін через напівпроникні перетинки (мембрани)
- •7.Основи масопереносу
- •8.Абсорбція
- •9.Перегонка рідин
- •10. Екстракція
- •11.Подрібнення
- •1 .Основи гідрокінетики
- •1.1 .Загальні відомості
- •1.2.Класифікація рідких неоднорідних систем та гідромеханічних процесів.
- •1.3. Методи очищення неоднорідних систем
- •2. Газоочищення.
- •2.1. Диференційне рівняння осадження частинок під дією сили тяжіння
- •2.2 Розв'язок диференційного рівняння з метою визначення швидкості осадження
- •2.3.Визначеннч швидкості осадження частинок пі дією сили тяжіння
- •2.4.Гравітаційне осадження . Визначення продуктивності газового відстійника
- •2.5. Розділення сумішей в полі відцентрових сил.
- •1.9. Циклонний процес.
- •Розрахунок циклонів
- •1.10. Осадження під дією електричного поля
- •2.Фільтрування Вступ
- •2.1 Кінетика фільтрування.
- •Виведення рівняння Нав'є – Стокса .
- •Отримання основного рівняння фільтрації
- •2.2.Основне рівняння фільтрації
- •Промивка осаду
- •3. Центрифугування
- •3.2. Розрахунок відстойної центрифуги
- •З.З.Центробіжне фільтрування
- •4. Перемішування
- •4.1. Перемішування в рідкій фазі
- •5.Псевдозріження твердого зернистого матеріалу
- •5.1. Гідродинамічна суть процесу псевдозрідження
- •5.2. Визначення еквівалентного діаметра каналу в зернистому слою. Гідравлічний опір зернистого слою
- •5.3. Визначення швидкості початку псевдозрідження
- •6. Масообмін через напівпроникні перетинки (мембрани)
- •6.1. Найважливіші мембранні методи та межі їх застосування.
- •6.2. Функціональні характеристики мембран.
- •6.3. Кінетика процесів мембранного розділення сумішей.
- •7. Основи масопереносу
- •7.1. Загальні відомості про масообмінні процеси.
- •7.2. Основне рівняння масопередачі
- •7.3. Рівняння і лінії рівноваги
- •7.4. Матеріальний баланс масообмінних процесів.
- •7.5. Рушійна сила масообмінних процесів
- •7.6. Модифіковане рівняння масопередачі.
- •7.10. Визначення числа одиниць переносу
- •7.11.Основні закони масопередачі
- •Диференційне рівняння масовіддачі ( конвективної дифузії)
- •7.12.Основи розрахунку масообмінних апаратів.
- •8.1 Рівновага в процесах абсорбції.
- •8.2. Кінетика процесу абсорбції
- •Абсорбція, що супроводжується хімічною реакцією
- •8.4. Тепловий баланс і температура абсорбенту.
- •8.5. Принципіальні схеми абсорбції
- •9.Перегонка рідин.
- •9.1. Характеристики двофазних систем рідина - пар.
- •9.2. Ректифікація
- •9.3. Аналіз роботи ректифікаційних колон
- •Матеріальний баланс ректифікаційних колон
- •Рівняння робочих ліній
- •Побудова робочих ліній на діаграмі у-х
- •10. Екстракція
- •10.1. Рівновага в процесах екстракції
- •10.2 Діаграма х-у
- •10.3. Трикутна діаграма
- •10.4. Зображення процесів розведення на трикутній діаграмі
- •10.5. Процеси змішування на трикутній діаграмі. Правило ричага
- •10.6. Крива рівноваги на трикутній діаграмі
- •10.7.3Находження хорд рівноваги і критичної точки
- •10.8. Види трикутних діаграм
- •10.9. Вплив температури на рівновагу
- •10.10. Матеріальний баланс екстракції
- •10.11. Кінетика екстракції
- •10.12. Принципові схеми екстракції
- •11.Подрібнення
- •11.2. Щокова дробарка. Визначення кута захвата
7.3. Рівняння і лінії рівноваги
Звичайно при розрахунках масообмінних процесів фактичні або робочі концентрації розподіляючої між фазами речовини задані. Аби знайти напрям процесу і його швидкість, необхідно знати рівноважні концентрації при робочих умовах, або залежність рівноважних концентрацій у* розподіляючої речовини в одній фазі від робочої концентрації х в іншій, тобто
y*=f(x); (7.3.1)
наприклад,
у* = т· xn; (7.3.2)
де m і n - величини, що визначаються дослідним шляхом.
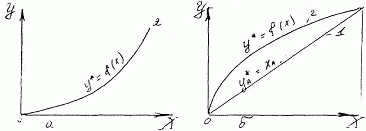
Значення m залежить від фізико-хімічних властивостей системи, від температури, тиску, а часто і від концентрації розподіляючої між фазами речовини. Тому на діаграмі в координатах У - X лінії рівноваги, які описуються залежностями (7.3.1) або (7.3.2) можуть мати вигляд кривих (Рис. 7.3.1,а.)
Рис.7.3.1.Фазові діаграми Y-X: а - за рівнянням (7.3.2); б - за рівнянням (7.3) 1 - робоча лінія; 2 - лінія рівноваги.
Для ідеальних систем (наприклад, розчинів) рівняння ліній рівноваги відомі. Наприклад, для ідеального розчину, якщо його температура вище критичної температури розчиняючого газу, використаємо закон Генрі, по котрому парціальний тиск розчиненого пропорційний його молярній долі в розчині:
Р* = Е·х; (7.3.3)
де р* - парціальний тиск поглинаючого газу над розчином, що знаходиться в рівновазі, при концентрації розчину х; Е - константа Генрі. Із закону Дальтона
p = P·Y (7.3.4) Тоді
![]() 7.3.5
7.3.5
де Р загальний тиск в системі.
Значення т в рівнянні (7.3.5) залежить від загального тиску і від температури. З ростом температури т збільшується зі збільшенням загального тиску значення т знижується, що призводить до збільшення розчинності газу.
При постійній температурі і тиску залежність між рівноважними значеннями у і робочими х виражається графічно прямою лінією, що проходить через початок координат, з кутом нахилу, тангенс котрого рівний т.
Закон Генрі виконується для ідеальних розчинів. Для реальних розчинів він використовується з достатньою точністю лише при сильному розбавленні. Для систем, які не підчиняються цьому закону, значення т в рівнянні (7.3.5) є змінною величиною і лінія рівноваги являє собою криву, котру будують звичайно по дослідним даним.
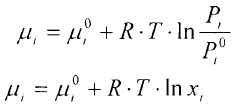
при умові рівності хімічних потенціалів:
Якщо температура ідеального розчину менше критичної температури, тобто відбувається конденсація газу то система підпорядковується закону Рауля, котрий можна отримати, співcтавивши вирази для хімічного потенціалу.
![]() (7.3.6)
(7.3.6)
і 3 виразу (7.2.8) випливає, що парціальний тиск пару І - того компоненту над розчином рівно добутку тиску пару чистого компоненту (тобто тиск насиченого пару цього компоненту) при температурі розчину на йог мольну долю в рідкій фазі.
Для двокомпонентної суміші складу А-В вираз (7.3.4) і (7.3.6) дають зв'язок між робочими і рівноважними концентраціями:
![]()
(7.3.7)
Р = Ра + РB = Р°А · ХА + а · (1 - ХА)
Звідки
![]()
Розділивши останній вираз на р0B і позначивши р0А /р0B через α (де α - відносна летучість компонентів), отримаємо
![]() (7.3.8)
(7.3.8)
Це рівняння є рівняння кривої лінії.
Часто приходиться користуватися експериментальними даними, так як закони розподілення отримані для ідеальних систем.
Знаючи рівноважні і робочі концентрації, можна знайти напрям процесу: з якої фази і в яку буде приходити розподіляюча між фазами речовина. Вважаємо, що співвідношення між робочими і рівноважними концентраціями відповідають (Рис.7.3.1,а). Якщо у > у* речовина
переходить з фази 1 в фазу 2 при цьому X < Х*. ЯкщоΥ<Υ* (при цьому Х>Х*), перехід речовини буде зворотнім - з фази 2 в фазу 1. Таким чином, розподіляємо між фазами речовина в точці контакту фаз переходить в ту фазу, робоча концентрація котрої менше рівноважної.
Крім того, знання різниці рівноважних і робочих концентрацій дозволяє визначити рушійну силу переносу маси, що необхідно для розрахунку швидкості процесу масопереносу.
