
- •Неорганическая химия биогенных элементов
- •Содержание
- •Введение
- •1 Понятие о биогенных элементах. Прогноз свойств химических элементов в зависимости от их положения в периодической системе
- •1.1 Биогенные элементы
- •1.2 Строение атома и Периодическая система химических элементов
- •1.3 Элементы первого периода (h, He)
- •1.4 Элементы второго периода (Li–Ne)
- •1.5 Элементы III периода (Na–Ar)
- •1 .6 Элементы IV периода (k–Kr)
- •1.7 Элементы V, VI и VII периодов
- •1.8 Прогнозирование свойств элементов, простых веществ и соединений
- •1.9 Образование химических связей
- •2 Кислотно-основные свойства соединений. Сравнение гидролизуемости солей
- •3 Комплексные соединения
- •3.1 Понятие о комплексных соединениях
- •3.2 Номенклатура комплексных соединений
- •3.3 Диссоциация комплексных соединений в растворах
- •3.4 Образование и разрушение комплексов
- •4 Окислительно-восстановительные реакции
- •4.1 Степени окисления атомов
- •4.2 Окислители
- •4.3 Восстановители
- •4.4 Окислительно-восстановительная двойственность
- •4.5 Окислительно-восстановительные потенциалы и направление протекания окислительно-восстановительных реакций
- •5 Расчёт концентраций ионов в насыщенных растворах соединений биогенных элементов. Возможность осаждения ионов из раствора в обменной реакции
- •5.1 Произведение растворимости
- •5.2 Определение возможности выпадения осадка малорастворимого электролита в обменной реакции
- •6 Расчёт pH в растворах кислот и оснований. Расчёт концентраций кислот и оснований по pH
- •Примеры задач на сильные электролиты
- •Примеры задач на слабые электролиты
- •Список литературы
1 .6 Элементы IV периода (k–Kr)
У последнего элемента III периода – аргона – полностью заполнены 3s- и 3p-подуровни, но свободны все 3d-орбитали. Однако, у следующих за аргоном элементов – калия и кальция – заполнение третьего электронного слоя временно прекращается и начинает формироваться s-подуровень внешнего четвёртого энергетического уровня:
K 1s22s22p63s23p63d04s1 Ca 1s22s22p63s23p63d04s2
Это объясняется тем, что 4s-орбиталь имеет более низкую энергию, чем свободные 3d-орбитали.
П осле
кальция появляется ряд из десяти
d-элементов (Sc–Zn), у которых происходит
заполнение 3d-орбиталей. Например, у
первого d-элемента
IV
периода скандия на d-орбиталях
находится один электрон,
осле
кальция появляется ряд из десяти
d-элементов (Sc–Zn), у которых происходит
заполнение 3d-орбиталей. Например, у
первого d-элемента
IV
периода скандия на d-орбиталях
находится один электрон,
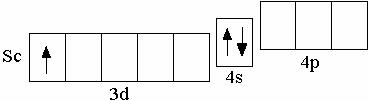
Sc 3d14s2
у третьего по счёту d-элемента
IV
периода – ванадия – на d-орбиталях
располагаются 3 электрона,
третьего по счёту d-элемента
IV
периода – ванадия – на d-орбиталях
располагаются 3 электрона,
V 3d34s2
У последнего (десятого) d-элемента IV периода – цинка – 10 d-электронов:

Zn 3d104s2
Следует
обратить внимание, что электронная
конфигурация атома хрома (четвёртый по
счёту d-элемент
IV
периода) не 3d44s2,
а 3d54s1.
Э то
объясняется «проскоком» одного электрона
с 4s-орбитали на 3d-орбиталь, в результате
чего образуется наполовину заполненный
3d-подуровень, обладающий повышенной
устойчивостью. Повышенной устойчивостью
обладают также полностью заполненные
электронами подуровни, вследствие чего
«проскок» электрона происходит также
у атома меди (медь – девятый d-элемент
IV
периода, однако его электронная
конфигурация не 3d94s2,
а 3d104s1).
После ряда d-элементов в IV
периоде идёт заполнение p-орбиталей у
элементов Ga – Kr,
электронная конфигурация которых
аналогична электронной конфигурации
p-элементов B – Ne
или Al – Ar.
то
объясняется «проскоком» одного электрона
с 4s-орбитали на 3d-орбиталь, в результате
чего образуется наполовину заполненный
3d-подуровень, обладающий повышенной
устойчивостью. Повышенной устойчивостью
обладают также полностью заполненные
электронами подуровни, вследствие чего
«проскок» электрона происходит также
у атома меди (медь – девятый d-элемент
IV
периода, однако его электронная
конфигурация не 3d94s2,
а 3d104s1).
После ряда d-элементов в IV
периоде идёт заполнение p-орбиталей у
элементов Ga – Kr,
электронная конфигурация которых
аналогична электронной конфигурации
p-элементов B – Ne
или Al – Ar.
1.7 Элементы V, VI и VII периодов
Электронная конфигурация элементов пятого периода полностью аналогична электронной конфигурации атомов элементов четвёртого периода, с той лишь разницей, что у s-элементов, которыми начинается пятый период, – рубидия и стронция – заполняется 5s-орбиталь, после чего начинается заполнение 4d-орбитали у атомов d-элементов (Y – Сd), и затем заполняются 5p-орбитали у p-элементов (In – Xe).
VI период, как и предыдущие, начинается с двух s-элементов (Cs и Ba). Далее, следует d-элемент лантан (5d16s2), а за ним – четырнадцать элементов (Ce – Lu) в атомах которых заполняются 4f-орбитали, т.е. орбитали третьего снаружи электронного слоя. Эти f-элементы называются лантаноидами. Заполнение 5d-подуровня, начатое у лантана, возобновляется у гафния и заканчивается у ртути. Далее, как и в предыдущих периодах, следуют p-элементы (Tl – Rn), у которых заполняется 6p-подуровень.
Седьмой, пока незавершённый период системы элементов построен аналогично шестому. После двух s-элементов (Fr и Ra) и одного d-элемента – актиния (Ac), – следует ряд из четырнадцати f-элементов, у которых заполняется 5f-подуровень третьего снаружи энергетического уровня. Эти f-элементы (Th – Lr) имеют общее название актиноиды.
1.8 Прогнозирование свойств элементов, простых веществ и соединений
Каждая группа элементов в Периодической таблице состоит из двух подгрупп – главной (подгруппа А) и побочной (подгруппа В). Главные подгруппы образованы s- и p-элементами, побочные – d-элементами.
Все s-элементы (кроме водорода и гелия) являются металлами. Металлами также являются все без исключения d- и f-элементы. Среди p-элементов есть как металлы, так и неметаллы. Если провести диагональ B–Si–As–Te–At, то окажется, что все p-элементы, находящиеся на этой диагонали и выше её – неметаллы. P-элементы, расположенные ниже диагонали – металлы, за исключением германия.
Чем более металличен элемент, тем более основные свойства характерны для его оксидов и гидроксидов, и, напротив, чем более неметалличен элемент, тем более кислотными свойствами обладают его оксиды и гидроксиды.
В периодах слева направо наблюдается ослабление металлических и усиление неметаллических свойств элементов и, как следствие, ослабление основных и усиление кислотных свойств оксидов и гидроксидов.
В главных подгруппах сверху вниз наблюдается усиление металличности элементов и усиление основных свойств оксидов и гидроксидов; кислотные же свойства ослабляются (сила кислородсодержащих кислот, образуемых элементами главных подгрупп, уменьшается при движении по подгруппе сверху вниз).
Сила бескислородных кислот, образуемых элементами главных подгрупп, увеличивается с увеличением порядкового номера элемента (т.е. при движении по подгруппе сверху вниз).
В побочных подгруппах проявляется тенденция к ослаблению металлических свойств при движении в подгруппе сверху вниз.
Кислотно-основные свойства оксидов и гидроксидов зависят от степени окисления элемента: с увеличением степени окисления ослабевают основные и усиливаются кислотные свойства.
