
- •Содержание
- •Правила техники безопасной работы в лаборатории биохимии
- •Лабораторная работа № 1 определение содержания влаги и сухих веществ
- •1.1 Определение содержания влаги методом высушивания в сушильном шкафу
- •Обработка результатов
- •Определение влаги в продуктах мясных методом высушиванием в сушильном шкафу при температуре (150±2)оС
- •Проведение испытания
- •Обработка результатов
- •1.2 Определение содержания влаги с помощью прибора «Элекс» (экспрессный метод)
- •1.3 Определение содержания сухих веществ с помощью рефрактометра
- •1.4 Пикнометрический метод определения относительной плотности и содержания растворимых сухих веществ
- •1.5 Определение массовой доли сухого вещества молока
- •Лабораторная работа №2 определение зольности и щелочности общей золы
- •2.1 Определение золы
- •2.2 Определение щелочности общей золы
- •Лабораторная работа № 3 качественные реакции на белки
- •3.1 Биуретовая реакция
- •3.2 Ксантопротеиновая реакция
- •3.3 Реакция с нингидрином
- •3.4 Реакция Миллона
- •3.5 Реакция Адамкевича
- •Реакция Фоля
- •Лабораторная работа № 4 определение содержания белка методом къельдаля
- •4.1 Сжигание
- •4.2 Отгонка
- •4.3 Титрование
- •4.4 Модификация а.М. Ермакова
- •Лабораторная работа № 5 исследование свойств простых белков
- •5.1 Выделение белков
- •5.1.1 Выделение альбуминовой фракции.
- •5.1.2 Выделение глобулиновой фракции.
- •5.1.3 Выделение склеропротеинов.
- •5.2 Осаждение белков
- •5.2.1 Высаливание белков сернокислым аммонием
- •5.2.2 Свертывание белков при нагревании
- •5.2.3Осаждение белков концентрированными минеральными кислотами
- •5.2.4 Осаждение белков органическими кислотами
- •5.2.5 Осаждение белков солями тяжелых металлов
- •5.2.6 Осаждение белков алкалоидными реактивами
- •5.2.7 Осаждение белков спиртом
- •Задания к теме
- •Проверь себя
- •Основные ферменты растительного сырья и их роль в обмене веществ
- •6.1 Определение активности каталазы
- •6.2 Проба на пероксидазу
- •7.3 Проба на фосфатазу
- •Задания к теме
- •Проверь себя
- •Лабораторная работа № 7 определение содержания редуцирующих сахаров методом бертрана
- •1,1 Мг меди соответствует х мг сахара
- •7.2 Определение массовой доли хлеба йодометрическим методом ( по гост 4288-76)
- •Лабораторная работа № 8 определение содержания сахарозы
- •Лабораторная работа № 9 определение содержания крахмала
- •Изменения крахмала
- •9.1 Определение крахмала методом Эверса в растительном сырье
- •Обработка результатов
- •9.2.1 Качественный метод определения крахмала
- •9.2.2 Определение массовой доли крахмала
- •9.3 Определение крахмала в кулинарных изделиях
- •9.3.2 Определение вложения риса
- •9.3.3 Определение манной крупы и пшеничной муки
- •10.1 Определение массовой доли декстринов
- •10.2 Определение декстринирующей способности α-амилазы
- •Лабораторная работа №11 определение содержания целлюлозы
- •Лабораторная работа № 12 определение содержания жира в пищевых продуктах
- •12.1 Определение жира методом настаивания
- •12. 2 Определение жира с помощью рефрактометра
- •Обработка результатов
- •Определение жира экстракционно-весовым
- •Обработка результатов
- •12.4 Определение содержания летучих жирных кислот (лжк) в мясе убойных животных (гост 23392-78)
- •Лабораторная работа № 13 определение содержания органических кислот
- •13.1 Определение содержания органических кислот в плодах и овощах
- •13.1 Проведение испытаний
- •13.2 Метод определения кислотности по болтушке
- •13.3 Определение концентрации водородных ионов (рН) мяса (по гост р 51478-99)
- •13.4 Определение концентрации водородных ионов (рН) яичных продуктов
- •13.6 Определение общей (титруемой) кислотности в кулинарных и мучных кулинарных изделиях
- •Лабораторная работа № 14 качественные реакции на витамины
- •14.1 Качественная реакция на витамин в2
- •14.2 Качественные реакции на витамин а
- •14.3 Качественные реакции на витамин д
- •14.4 Качественные реакции на витамин е
- •14.5 Качественная реакция на витамин в1
- •14.6 Качественная реакция на витамин рр
- •14.7 Качественные реакция на витамин р
- •14.8 Определение содержания аскорбиновой кислоты
- •14.9 Определение содержания каротиноиидов
- •13.10 Определение содержания витамина к
- •Список литературы
5.2.7 Осаждение белков спиртом
В пробирку наливают 1-1,5 см3 раствора белка и добавляют немного кристаллического хлористого натрия. Приливают постепенно туда же 5-6 см3 этилового спирта. Выпадает хлопьевидный осадок белка вследствие дегидратации белковых молекул при добавлении спирта.
Задания к работе
Записать результаты реакций осаждения белков при действии органических и неорганических осадителей в виде таблицы 5.1.
Таблица 5.1
Название групп осадителей |
Используемые реактивы и химические вещества |
Характер и цвет осадка |
Чем обусловлена реакция |
|
|
|
|
Контрольные вопросы
Наличие каких функциональных групп обуславливает взаимодействие белка с солями тяжелых металлов?
Какие изменения происходят в структуре белка при нагревании? Меняется ли его первичная структура?
Как называется процесс свертывания белков ? Почему свернувшийся белок не растворяется в воде?
4. Что наблюдается при добавлении к белку гидроксида натрия и кислоты?
5. Чем может быть вызвана денатурация белков?
6. От чего зависит заряд белка в водном растворе?
7. Какие реактивы осаждают белки необратимо?
Задания к теме
Выберите правильно парные сочетания ключевых слов и смысловых предложений.
А. Нативный белок. |
а) вещество, ослабляющее взаимодействие белковых молекул с другими макромолекулами; |
Б. Денатурированный белок. |
б) один из методов очистки белка; |
В. Детергент. |
в) индивидуальный белок; |
Г. Электродиализ. |
г) белок, с присущим ему в естественном состоянии свойствами; |
Д. Гомогенный белок. |
д) белок, потерявший природные свойства. |
2.Выберите правильно парные сочетания ключевых слов и смысловых завершающих предложений.
А) Альбумины. |
а) хорошо растворимы в воде; |
Б) Протамины. |
б) содержит не менее 30 % основных аминокислот; |
В) Глобулины. |
в) растворяются в 70-80% спирте; |
Г) Гистон. |
г) не растворяются в воде и солевых растворах умеренных концентраций; |
Д) Проламины. |
д) содержит 80-90% аргинина. |
3.Что такое первичная структура белка?
А) Последовательность аминокислотных остатков в полипептидной цепи;
Б) Полинуклеотидная цепь;
В)Макромолекула, состоящая из отдельных полипептидных цепей;
Г)Трехмерная конфигурация закрученной спирали.
4. Какую качественную реакцию дают все белки?
А)Ксантопротеиновая;
Б)Серебряного зеркала;
В)Фелинга;
Г)Нингидриновая.
5. Какую функцию не выполняют белки в организме животных?
А)Транспортную;
Б)Резервную;
В)Структурную;
Г)Регуляторную.
6. Какие связи не участвуют в образовании третичной структуры?
А)Водородные;
Б)Гидрофобные;
В)Сложноэфирные;
Г)Дисульфидные.
Проверь себя
Белки-биополимеры, мономерами которых являются:
а) амины; б) β-аминокислоты; в) α-аминокислоты; г) амиды карбоновых кислот.
2. В белках аминокислоты связаны: а) сложноэфирными; б) водородными; в) пептидными; г) гликозидными связями.
3. В изоэлектрической точке пептиды имеют заряд: а) отрицательный; б) положительный; в) нулевой.
4. Между остатками треонина и глутамина при формировании третичной структуры белка возникает связь: а) оинная; б) ковалентная; в) дисульфидная; г) водородная.
Лабораторная работа № 6
ОПРЕДЕЛЕНИЕ ФЕРМЕНТАТИВНОЙ
АКТИВНОСТИ КАТАЛАЗЫ И ЭФФЕКТИВНОСТИ
ТЕПЛОВОЙ ОБРАБОТКИ МЯСНЫХ И РЫБНЫХ
КУЛИНАРНЫХ ИЗДЕЛИЙ
Продолжительность работы 4 часа.
Цель работы: исследование активности каталазы в различных растительных объектах и влияния сульфитации на активность каталазы и оценка качества тепловой обработки мясных изделий.
Теоретические положения
Ферментами (энзимами) называют белковые вещества, образующиеся в клетках и тканях организма, обладающие каталитической активностью, способные ускорять протекание химических реакций. Каждый фермент катализирует только одну химическую реакцию. При этом сам фермент разрушается в незначительной степени. Скорость ферментативной реакции зависит от количества и активности фермента, концентрации субстрата, рН и состава раствора, температуры, присутствия активаторов и ингибиторов. Таким образом, ферменты – это биологические катализаторы. Катализ может быть положительным (ускорение реакции) или отрицательным (замедление реакции).
Впервые фермент был открыт в 1814 г. профессором Петербургской академии Кирхгофом. В настоящее время известно более 3000 ферментов.
Ферменты бывают простыми белками (протеинами) и сложными (протеидами). Их молекулярная масса колеблется в широких пределах от 12·103 до 10·106 Да. Ферменты называют по тому веществу, на которое они действуют, прибавляя к корню «аза» – липаза, лактаза, пептидаза.
С точки зрения локализации ферменты подразделяют на внеклеточные и внутриклеточные. Внеклеточные ферменты выделяются клеткой во внешнюю среду. Многие из них синтезируются микроорганизмами и вызывают расщепление биополимеров. Внутриклеточные ферменты локализованы либо в клеточных органеллах, либо в комплексе с надмолекулярными структурами. Установлено, что в ядре клетки локализованы ферменты, принимающие участие в синтезе РНК и ДНК; с митохондриями связаны ферменты окисления жирных кислот, продуктов распада углеводов; в лизосомах содержатся ферменты гидролиза; с рибосомами связаны ферменты белкового синтеза [Жеребцов].
Так, например разные мышцы в зависимости от функциональных особенностей отличаются концентрацией ферментов. Красные мышцы содержат больше всего митохондрий по сравнению с белыми и отличаются высокой активностью окислительных ферментов [Данилова].
Многим ферментам для эффективной работы требуются те или иные небелковые компоненты, называемые кофакторами. Кофакторы подразделяются на три типа: неорганические ионы, простетические группы и коферменты.
Неорганические ионы (активаторы ферментов) заставляют молекулы фермента или субстрата принять форму, способствующую образованию фермент-субстратного комплекса. Так, например, активность амилазы слюны повышается в присутствии хлорид-ионов.
Если кофактор прочно связан с ферментом и остается в этом связанном состоянии постоянно, то его называют простетической группой (от греч. prostheke - добавление), роль, которой играют органические молекулы.
Коферменты – это органические молекулы (небелковые вещества), легко отделяющиеся от белковой части фермента и способные существовать самостоятельно. Коферментами могут быть металлы, витамины В1, В2, В6, РР, биотин, пантотеновая кислота и др. соединения. Не могут синтезироваться организмом человека и животных. Коферменты термостабильны, а белковая часть – апофермент – термолабильна и легко денатурирует при определенных внешних воздействиях.
От обычных функциональных белков ферменты отличает то, что на поверхности белковой глобулы у них располагается активный центр. Это участок, образованный из (рисунок 6.1) различных аминокислотных остатков, собранных из различных областей полипептидной цепи, где происходит связывание и превращение субстрата. При этом субстратом называется химическое соединение, претерпевающее изменение в ходе каталитического процесса. Кроме активного центра, у некоторых ферментов имеется еще и регуляторный участок. По размерам белковая глобула фермента превышает в несколько раз размеры субстрата.
В активном центре фермента могут
располагаться аминокислотные остатки,
содержащие различные функциональные
группы, которые принимают участие в
каталитическом процессе.
активном центре фермента могут
располагаться аминокислотные остатки,
содержащие различные функциональные
группы, которые принимают участие в
каталитическом процессе.
Рисунок 6.1 – Активный центр и регуляторный участка на поверхности белковой глобулы фермента
Условно активный центр фермента можно разделить на два участка: сорбционный, функциональные группы которого отвечают за связывание субстрата в активном центре фермента, и каталитический, в котором происходит превращение субстрата. Размер активного центра фермента, определяется размером субстрата (гипотеза «ключа и замка» - субстрат – ключ, фермент – замок, предложенная в 1890 г. Фишером). Константа, характеризующая эффективность превращения субстрата в активном центре фермента называется каталитической (kkat), а константа, определяющая сродство субстрата к ферменту – константа связывания (KS ≈ Km). Действие эффектов (активаторов и ингибиторов) определяют с помощью константы активирования (Ка) и ингибирования (Кi).
Известны различные низкомолекулярные соединения, которые могут снижать скорость ферментативных реакций. Такие соединения называются ингибиторами ферментов. Важно понимать, что ингибирование – это один из нормальных способов регулирования активности ферментов. Ингибирование бывает конкурентным и неконкурентным (обратимым и необратимым).
О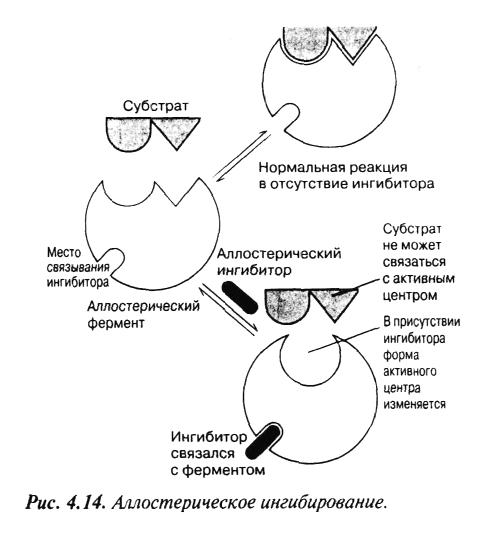 дин
из самых обычных способов регуляции
метаболических путей – это регуляция
с помощью аллостерических ферментов
(рисунок 6.2). Аллостерическими называют
ферменты, действие которых связано с
изменением формы (allos –
иной, другой; stereos – форма).
дин
из самых обычных способов регуляции
метаболических путей – это регуляция
с помощью аллостерических ферментов
(рисунок 6.2). Аллостерическими называют
ферменты, действие которых связано с
изменением формы (allos –
иной, другой; stereos – форма).
Рисунок 6.2 – Аллостерическое ингибирование
Особенностью любого фермента является то, что он воздействует на определенные функциональные группировки и способен на определенную химическую реакцию. При этом из массы окружающих веществ он должен выбрать одно, с которым фермент будет каким-либо образом взаимодействовать. Ферментативная реакция делится на несколько этапов (рисунок 6.3):
В окружающей среде фермент отыскивает нужное ему вещество.
Фермент присоединяет к себе найденное вещество и воздействует на него. Происходит образование комплекса фермент-субстрат.
Происходит отторжение в окружающую среду присоединенного вещества, но видоизмененного.


Рисунок 6.3 – Схема ферментативной реакции
В 1959 г. Кошланд предложил новую гипотезу, получившую название гипотеза «индуцированного соответствия». На основе имеющихся данных, он заключил, что субстрат, соединяясь с ферментом, вызывает какие-то изменения в структуре его активного центра. Аминокислотные остатки, составляющие активный центр фермента, принимают определенную форму, которая дает возможность ферменту наиболее эффективным образом выполнять свою функцию. Подходящей аналогией в этом случае может служить перчатка, которая при надевании на руку соответствующим образом изменяет свою форму.
Активность фермента зависит от природы и концентрации фермента и субстрата, межсубъединичных взаимодействий белковых глобул (для ферментов с четвертичной структурой), состава раствора, природы растворителя, ионной силы раствора, рН среды, присутствия ингибиторов и активаторов, температуры, давления, УФ-облучения, рентгеновского излучения и др.
Активность ферментов выражают в стандартных единицах Е, которые соответствуют количеству фермента, катализирующего превращение субстрата со скоростью 1 мкмоль в 1 мин при стандартных условиях. Более новая единица – катал (кат), соответствующая количеству фермента, катализирующего превращение субстрата со скоростью 1 моль в 1 с (1 кат = 6∙107 Е).
