
- •«Неорганическая химия» Часть II
- •Общие методические рекомендации по изучению дисциплины
- •Содержание дисциплины
- •Тема 8 Периодический закон и периодическая таблица д.И.Менделеева.
- •Тема 9 Водород
- •Тема 10. Галогены
- •Тема 11. Элементы via группы периодической системы
- •Тема 12 Элементы va группы периодической системы
- •Тема 13. Подгруппа углерода
- •8. Периодический закон и периодическая таблица д.И.Менделеева.
- •Контрольные задания
- •10. Галогены
- •Вопросы для самоподготовки
- •Вопросы для самоподготовки
- •Кислородные соединения азота
- •15.3. Углерод
- •15.4. Кремний
- •15.5. Олово (Sn)
- •Тема 15. Вторая группа периодической системы
- •«Щелочные металлы»
- •Контрольные задания
- •Тема 17 Элементы побочных подгрупп периодической системы, d-металлы.
8. Периодический закон и периодическая таблица д.И.Менделеева.
Периодическая система элементов Д. И. Менделеева.
В настоящее время известно более 500 вариантов изображения периодической системы; это различные формы передачи периодического закона. Первым вариантом системы элементов, предложенным Д. И. Менделеевым 1 марта 1869 г., был так называемый вариант длинной формы, В этом варианте периоды располагались одной строкой. В декабре 1870 г. он опубликовал второй вариант периодической системы — так называемую короткую форму. В этом варианте периоды разбиваются на ряды, а группы — на подгруппы (главную и побочную).
Короткий вариант периодической системы состоит из периодов, рядов и групп. Рассмотрим его несколько подробнее.
В периодической системе по горизонтали имеется 7 периодов (обозначены римскими цифрами), из них I, II и III называются малыми, а IV, V, VI и VII — большими. В первом периоде находится 2 элемента, во втором и третьем — по 8, в четвертом и пятом — по 18, в шестом — 32, в седьмом (незавершенном) — 21 элемент. Каждый период, за исключением первого, начинается щелочным металлом и заканчивается благородным газом (VII период — незаконченный).
Все элементы периодической системы пронумерованы в том порядке, в каком они следуют друг за другом. Номера элементов называются порядковыми или атомными номерами.
Элементы II и III периодов Менделеев назвал типическими. Свойства их закономерно изменяются от типичного металла до благородного газа. Закономерно изменяются в периодах и формы соединений элементов.
В системе 10 рядов (обозначены арабскими цифрами). Каждый малый период состоит из одного ряда, каждый большой период— из двух рядов: четного (верхнего) и нечетного (нижнего). В четных рядах больших периодов (четвертом, шестом, восьмом и десятом) находятся одни металлы, и свойства элементов в ряду слева направо изменяются слабо. В нечетных рядах больших периодов (пятого, седьмого и девятого) свойства элементов в ряду слева направо изменяются, как у типических элементов.
Основным признаком, по которому элементы больших периодов разделены на два ряда, является их степень окисления. Их одинаковые значения дважды повторяются в периоде с ростом атомных масс элементов. Например, в IV периоде степени окисления элементов от К до Мn изменяются от +1 до +7, затем следует триада Fe, Co, Ni (это элементы четного ряда), после чего наблюдается такое же возрастание степеней окисления у элементов от Сu до Вr (это элементы нечетного ряда). То же мы видим в остальных больших периодах, исключая VII, который состоит из одного (четного) ряда. Дважды повторяются в больших периодах и формы соединений элементов.
В VI периоде вслед за лантаном располагаются 14 элементов с порядковыми номерами 58—71, называемых лантаноидами. Лантаноиды помещены отдельно внизу таблицы, а в клетке звездочкой указано на последовательность их расположения в системе La — Lu. Химические свойства лантаноидов очень сходны. Например, все они являются реакционноспособными металлами, реагируют с водой с образованием гидроксида и водорода. Из этого следует, что у лантаноидов сильно выражена горизонтальная аналогия. В VII периоде 14 элементов с порядковыми номерами 90—103 составляют семейство актиноидов. Их также помещают отдельно — под лантаноидами, а в соответствующей клетке двумя звездочками указано на последовательность их расположения в системе Ас — Lr. Однако в отличие от лантаноидов горизонтальная аналогия у актиноидов выражена слабо. Они в своих соединениях проявляют больше различных степеней окисления. Например, степень окисления актиния +3, а урана +3, +4, +5 и +6. Изучение химических свойств актиноидов крайне сложно вследствие неустойчивости их ядер.
В периодической системе по вертикали расположены восемь групп (обозначены римскими цифрами). Номер группы связан со степенью окисления элементов, проявляемой ими в соединениях. Как правило, высшая положительная степень окисления элементов равна номеру группы. Исключением являются фтор — его степень окисления равна —1; медь, серебро, золото проявляют степень окисления +1, +2 и +3; из элементов VIII группы степень окисления +8 известна только для осмия, рутения и ксенона.
В VIII группе размещены благородные газы. Ранее считалось, что они не способны образовать химические соединения. Позднее были получены химические соединения благородных газов, например тетрафторид ксенона XeF4.
Каждая группа делится на две подгруппы — главную и побочную, что в периодической системе подчеркивается смещением одних вправо, а других влево. Главную подгруппу (А подгруппу) составляют типические элементы (элементы II и III периодов) и сходные с ними по химическим свойствам элементы больших периодов. Побочную подгруппу (В подгруппу) составляют только металлы — элементы больших периодов. VIII группа отличается от остальных. Кроме главной подгруппы гелия она содержит три побочные подгруппы: подгруппу железа, подгруппу кобальта и подгруппу никеля.
Химические свойства элементов главных и побочных подгрупп значительно различаются. Например, в VII группе главную подгруппу составляют неметаллы F, CI, Br, I, At, побочную — металлы Мn, Тс, Re. Таким образом, подгруппы объединяют наиболее сходные между собой элементы.
Все элементы, кроме гелия, неона и аргона, образуют кислородные соединения; существует всего 8 форм кислородных соединений. В периодической системе их часто изображают общими формулами, расположенными под каждой группой в порядке возрастания степени окисления элементов: R20, RO, R203, RO2, R205, R03, R207, R04, где R — элемент данной группы. Формулы высших оксидов относятся ко всем элементам группы, кроме тех случаев, когда элементы не проявляют степени окисления, равной номеру группы.
Элементы главных подгрупп, начиная с IV группы, образуют газообразные водородные соединения. Форм таких соединений 4. Их также изображают общими формулами в последовательности RH4, RH3, RH2, RH. Формулы водородных соединений располагаются под элементами главных подгрупп и только к ним относятся.
Свойства элементов в подгруппах закономерно изменяются: сверху вниз усиливаются металлические свойства и ослабевают неметаллические. Очевидно, металлические свойства наиболее сильно выражены у франция, затем у цезия; неметаллические — у фтора, затем — у кислорода.
Типы аналогии элементов
Учение о строении атомов вскрыло глубокий физический смысл периодического закона. Главной характеристикой атома является положительный заряд ядра, это более общая и точная характеристика атома, а значит, и элемента. Заряд ядра определяет число электронов в электронной оболочке атома, ее строение, а тем самым все свойства элемента и его положение в периодической системе.
Современная формулировка периодического закона Д. И. Менделеева такова: свойства химических элементов, а также формы и свойства соединений элементов находятся в периодической зависимости от заряда ядер их атомов.
Теория строения атомов объясняет периодическое изменение свойств элементов. Возрастание положительных зарядов атомных ядер от 1 до 107 обусловливает периодическое повторение строения внешнего энергетического уровня. А поскольку свойства элементов в основном зависят от числа электронов на внешнем уровне, то и они периодически повторяются. В этом — физический смысл периодического закона.
В малых периодах с ростом положительного заряда ядер атомов возрастает число электронов на внешнем уровне (от 1 до 2— в I периоде, и от 1 до 8 — во II и III периодах), что объясняет изменение свойств элементов: в начале периода (кроме I периода) находится щелочной металл, затем металлические свойства постепенно ослабевают и усиливаются свойства неметаллические.
В больших периодах с ростом заряда ядер заполнение уровней электронами происходит сложнее, что объясняет и более сложное изменение свойств элементов по сравнению с элементами малых периодов. Так, в четных рядах больших периодов с ростом заряда число электронов на внешнем уровне остается постоянным и равно 2 или 1. Поэтому, пока идет заполнение электронами следующего за внешним (второго снаружи) уровня, свойства элементов в этих рядах изменяются крайне медленно. Лишь в нечетных рядах, когда с ростом заряда ядра увеличивается число электронов на внешнем уровне (от 1 до 8), свойства элементов начинают изменяться так же, как у типических.
В свете учения о строении атомов становится обоснованным разделение Д. И. Менделеевым всех элементов на семь периодов. Номер периода соответствует числу энергетических уровней атомов, заполняемых электронами. Поэтому s-элементы имеются во всех периодах, р-элементы— во II и последующих, d-элементы—-в IV и последующих и f-элементы — в VI и VII периодах. .
Деление групп на подгруппы основано на различии в заполнении электронами энергетических у ровней. У элементов главных подгрупп заполняются или s-подуровни (s-элементы), или р-подуровни (р-элементы) внешних уровней. У элементов побочных подгрупп заполняется d-подуровень второго снаружи уровня (d-элементы). У лантаноидов и актиноидов заполняются соответственно 4f- и 5f-подуровни (f-элементы). Таким образом, в каждой подгруппе объединены элементы, атомы которых имеют сходное строение внешнего электронного уровня. При этом атомы элементов главных подгрупп содержат на внешних уровнях число электронов, равное номеру - группы. В побочные же подгруппы входят элементы, атомы которых имеют на внешнем уровне по два или по одному электрону. Все элементы группы называются групповыми аналогами. А элементы подгруппы – типовыми аналогами.
Различия в строении обусловливают и различия в свойствах элементов разных подгрупп одной группы. Так, на внешнем уровне атомов элементов подгруппы галогенов имеется по семь электронов, а подгруппы марганца — по два электрона. Первые — типичные неметаллы, а вторые — металлы.
Но у элементов этих подгрупп есть и общие свойства: вступая в химические реакции, все они (за исключением фтора F) могут отдавать по 7 электронов на образование химических связей. При этом атомы подгруппы марганца отдают 2 электрона с внешнего и 5 электронов со следующего за ним уровня. Таким образом, у элементов побочных подгрупп валентными являются электроны не только внешних, но и предпоследних (вторых снаружи) уровней, в чем состоит основное различие в свойствах элементов главных и побочных подгрупп. Отсюда же следует, что номер группы, как правило, указывает число электронов, которые могут участвовать - в образовании химических связей. В этом — физический смысл номера группы.
Итак, строение атомов обусловливает две закономерности:
1) изменение свойств элементов по горизонтали — в периоде слева направо ослабляются металлические и усиливаются неметаллические свойства;
2) изменение свойств элементов по вертикали — в подгруппе с ростом порядкового номера усиливаются металлические свойства и ослабевают неметаллические.
В таком случае элемент (и клетка системы) находится на пересечении горизонтали и вертикали, что определяет его свойства.
Свойства химического элемента объединяют все без исключения его характеристики в состоянии свободных атомов или ионов, в состоянии простого вещества, а также формы и свойства образуемых им многочисленных соединений. Но обычно под свойствами химического элемента подразумевают, во-первых, свойства его свободных атомов и, во-вторых, свойства простого вещества. Большинство этих свойств проявляет явную периодическую зависимость от атомных номеров химических элементов. Среди этих свойств наиболее важными, имеющими особое значение при объяснении или предсказании химического поведения элементов и образуемых ими соединений являются:
энергия ионизации атомов;
энергия сродства атомов к электрону;
электроотрицательность;
атомные (и ионные) радиусы;
энергия атомизации простых веществ
степени окисления;
окислительные потенциалы простых веществ.
Зависимость энергии ионизации атома от порядкового номера элемента (рис. 1) носит отчетливо периодический характер. Легче всего удалить электрон из атомов щелочных металлов, включающих по одному валентному электрону, труднее всего — из атомов благородных газов, обладающих замкнутой электронной оболочкой. Поэтому периодичность изменения энергии ионизации атомов характеризуется минимумами, отвечающими щелочным металлам, и максимумами, приходящимися на благородные газы. Наряду с этими резко выраженными минимумами и максимумами на кривой энергии ионизации атомов наблюдаются слабо выраженные минимумы и максимумы, которые по-прежнему нетрудно объяснить с учетом эффектов экранирования и проникновения, эффектов межэлектронных взаимодействий и т. д.

Рис. 1 Зависимость энергии ионизации атомов от порядкового номера элемента.
Периодичность значений энергий сродства атомов к электрону (рис.2.) объясняется, естественно, теми же самыми факторами, что ионизационных потенциалов. Наибольшим сродством к электрону обладают p-элементы VII группы. Наименьшее сродство к электрону у атомов с конфигурацией s2 (Be, Mg, Zn) и s2p6 (Ne, Ar) или с наполовину заполненными p-орбиталями (N, P, As):
В периодах наблюдается общая тенденция роста электроотрицательности, а в подгруппах — её падение. Наименьшая электроотрицательность у s-элементов I группы, наибольшая — у p-элементов VII группы.
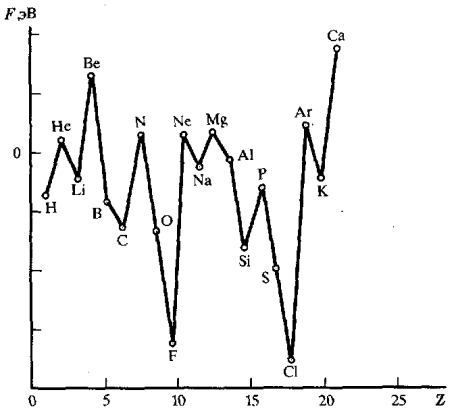
Рисунок 2 ‑ Зависимость сродства к электрону атома от атомного номера элемента.
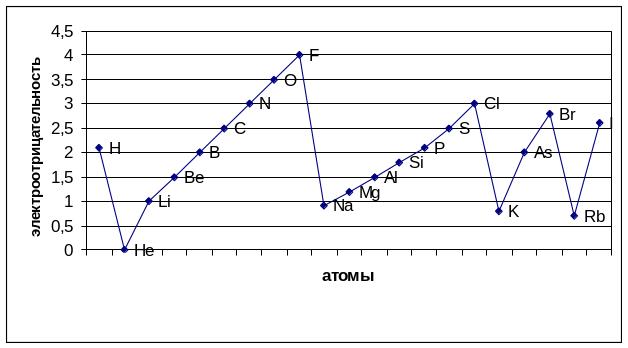
Рисунок 3 ‑ Шкала электроотрицательности
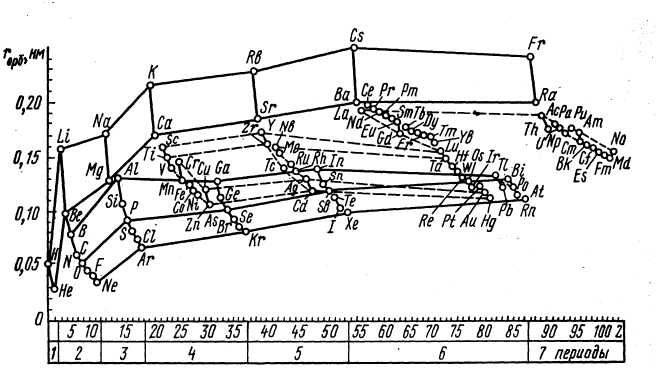
Периодичность в изменении значений орбитальных атомных радиусов в зависимости от порядкового номера элемента проявляется довольно отчетливо (см. рис. 4), и основные моменты здесь состоят в наличии очень ярко выраженных максимумов, приходящихся на атомы щелочных металлов, и таких же минимумов, отвечающих благородным газам. Уменьшение значений орбитальных атомных радиусов при переходе от щелочного металла к соответствующему (ближайшему) благородному газу носит, за исключением ряда Li—Ne, немонотонный характер, особенно при появлении между щелочным металлом и благородным газом семейств переходных элементов (металлов) и лантаноидов или актиноидов. В больших периодах в семействах d- и f-элементов наблюдается менее резкое уменьшение радиусов, так как заполнение орбиталей электронами происходит в пред- предвнешнем слое. В подгруппах элементов радиусы атомов и однотипных ионов в общем увеличиваются.
Энергия атомизации простых веществ является характеристикой, которая во многом определяет их реакционную способность. Зависимость энергии атомизации простых веществ от порядкового номера элемента имеет периодический характер. Основные моменты такой периодической зависимости состоят в следующем: энергия атомизации растет при переходе от щелочного металла (для них эти значения сравнительно невелики и близки 84 кДж/моль) к следующим за ним элементам, достигает максимума, затем убывает, становясь очень небольшой для галогена (63—126 кДж/моль) и, наконец, превращается в нуль в случае примыкающего к галогену благородного газа, который, как известно, при стандартных условиях существует в виде практически не взаимодействующих атомов. Положение максимума энергии атомизации в ряду элементов от щелочного металла до соответствующего (ближайшего) благородного газа зависит от многих факторов, выходящих за рамки настоящего изложения. Так, в ряду Li—Ne наибольшей энергией атомизации характеризуется углерод (718,2 кДж/моль), а в рядах K—Kr и Cs—Rn наибольшими энергиями атомизации обладают переходные металлы: ванадий (516,6 кДж/моль) и вольфрам (844,2 кДж/моль). Неравномерное изменение энергии атомизации в пределах одного ряда элементов от щелочного металла до благородного газа оказывается довольно сложным, особенно если этот ряд включает семейство переходных металлов.
Одним из основных понятий в химии было и остается понятие степени окисления (ступень окисления, состояние окисления, окислительное состояние). Многие элементы способны проявлять не одну, а несколько различных степеней окисления. Например, для хлора известны все степени окисления от −1 до +7, хотя четные очень неустойчивы, а для марганца — от +2 до +7. Высшие значения степени окисления изменяются в зависимости от порядкового номера элемента периодически, но эта периодичность имеет сложный характер. В простейшем случае в ряду элементов от щелочного металла до благородного газа высшая степень окисления возрастает от +1 (RbF) до +8 (XeО4). В других случаях высшая степень окисления благородного газа оказывается меньше, чем для предшествующего галогена. Поэтому на кривой периодической зависимости высшей, степени окисления от порядкового номера элемента максимумы приходятся или на благородный газ, или на предшествующий ему галоген (минимумы — всегда на щелочной металл). Исключение составляет ряд Li—Ne, в котором ни для галогена (F), ни для благородного газа (Ne) вообще неизвестны высокие степени окисления, а наибольшим значением высшей степени окисления обладает средний член ряда — азот; поэтому в ряду Li—Ne изменение высшей степени окисления оказывается проходящим через максимум. В общем случае возрастание высшей степени окисления в ряду элементов от щелочного металла до галогена или до благородного газа происходит отнюдь не монотонно, главным образом по причине проявления высоких степеней окисления переходными металлами. Например, возрастание высшей степени окисления в ряду Rb—Xe от +1 до +8 «осложняется» тем, что для молибдена, технеция и рутения известны такие высокие степени окисления, как +6 (MoО3), +7 (Tc2О7), +8 (RuO4).
Рассмотрим типы аналогии элементов на примере IV группы:
|
|
|
|
С |
1 |
Т |
|
|
|
|
|
Si |
[Ne]3s23p2 |
|
|
|
С |
[Ar]4s23d2 |
Ti |
|
|
|
|
Шринк аналоги |
|
|
Ge |
[Ar]4s23d104p2 |
Слоевые аналоги |
||
[Kr]5s24d2 |
Zr |
|
|
||||
|
|
Sn |
[Kr]5s24d105p2 |
||||
[Xe]6s24f145d2 |
Hf |
|
|
||||
|
|
|
|
Pb |
[Xe]6s24f145d106p2 |
||
|
|
|
|
|
|
Все семь элементов – групповые аналоги и неполные электронные аналоги. Свойства соединений этих элементов близки лишь в высшей степени окисления.
Э лементы
подгрупп с одинаковым типом валентных
электронных оболочек – типовые аналоги:
С, Si, Ge, Sn, Pb – типовые аналоги и Ti, Zr, Hf
– типовые аналоги. Наблюдается похожесть
свойств соединений в одинаковых степенях
окисления.
лементы
подгрупп с одинаковым типом валентных
электронных оболочек – типовые аналоги:
С, Si, Ge, Sn, Pb – типовые аналоги и Ti, Zr, Hf
– типовые аналоги. Наблюдается похожесть
свойств соединений в одинаковых степенях
окисления.
Ge, Sn, Pb – полные электронные аналоги, так же как и Ti, Zr, Hf. Это две группы слоевых аналогов. Свойства этих элементов близки во всех степенях окисления.
Zr, Hf – шринк аналоги (контракционные) из-за близости их радиусов, вследствие f- сжатия. Свойства их соединений очень похожи.
С и Si не являются полными электронными аналогами, т.к. у Si существует свободный 3d-электронный уровень, а у С 2d-уровня не бывает. Более четко такое различие видно на свойствах элементов V, VI, VII групп. Элементы кислород и сера (O 1s22s22p4 и S 1s22s22p63s23p4 ), не являются полными электронными аналогами, что сказывается на возможных валентностях этих элементов:
O |
1s22s22p4 |
|
O * |
2s 2p B=2 |
S |
1s22s22p63s23p4 |
3s 3p B=2 |
S* |
3s 3p 3d B= 6 |
Контрольные задания
Выберите атомы, являющиеся полными электронными аналогами. Ответ обоснуйте.
а) Zn, Cd, Hg; б) N, P, As; в) Si, Ge, Sn
Выберите атомы, являющиеся полными электронными аналогами. Ответ обоснуйте.
а) Нe, Ne, Ar; б) N, O, F; в) Cu, Ag, Au
Выберите атомы, являющиеся полными электронными аналогами. Ответ обоснуйте.
а) Н, F, Cl; б) C, Si, Ge; в) Cr, Mo, W
Выберите атомы, являющиеся полными электронными аналогами. Ответ обоснуйте. :
а) Zn, Cd, Hg; б) N, P, As; в) Si, Ge, Sn
Выберите ряд, в котором радиус атомов увеличивается. Ответ обоснуйте. Как сказывается увеличение радиуса атома на кислотно-основные свойства гидроксидов этих элементов? а) W, Mo, Cr б) Nb, Zr, Y в) Mg, Ca, Sr?
Выберите ряд, в котором радиус атомов увеличивается. Ответ обоснуйте. Как сказывается увеличение радиуса атома на кислотно-основные свойства гидроксидов этих элементов? а) Bi, Pb, Tl б) V, Ti, Sc в) C, N, O?
Выберите ряд, в котором радиус атомов увеличивается. Ответ обоснуйте. Как сказывается увеличение радиуса атома на кислотно-основные свойства гидроксидов этих элементов? а) Nd, Pm, Sm б) Ni, Co, Fe в) P, As, Sb?
В каком ряду ионный характер гидридов уменьшается? Ответ обоснуйте: а) S, P, Si; б) Li,Be, B; в) Ti,V,Cr
Сущность явления d- и f- сжатия (контракции). Выберите ряд элементов, свойства которых близки из-за d-контракции: а) S, Se; б) Ti, Zr, в) F, Cl?
Какие элементы являются горизонтальными аналогами: а) Na, Mg, Al; б) Ru, Rh, Pd; в) Tl, Pb, Bi? Укажите причины горизонтальной аналогии.
Какие элементы являются горизонтальными аналогами: а) Ag, Cd, In; б) Os, Ir, Pt; в) C, Si, Ge? Укажите причины горизонтальной аналогии.
Какие элементы являются слоевыми аналогами: а) Сl, Br, I; б)Nb, Mo, Te в)As, Sb, Bi Укажите причины слоевой аналогии.
Какие элементы являются слоевыми аналогами: а) Se, Te, Po; б)Li, Na, K в) U, Np, Pu? Укажите причины слоевой аналогии.
Какие элементы являются слоевыми аналогами: а) O, S, Se; б) Ga, In, Tl в) Fe, Co, Ni?? Укажите причины слоевой аналогии.
Сущность явления d- и f- сжатия (контракции). Выберите ряд элементов, свойства которых близки из-за f-контракции: а) Se, Te; б) Zr, Hf; в) Sr, Ba?
Сущность явления d- и f- сжатия (контракции). Выберите ряд элементов, свойства которых близки из-за d-контракции: а) S, P; б) Na, K, в) Ag, Au?
Сущность явления d- и f- сжатия (контракции). Выберите ряд элементов, свойства которых близки из-за f-контракции: а) Co, Ni; б) Zn, Cd; в) Zr, Hf?
Что является причиной внутренней периодичности свойств элементов? Приведите примеры.
Понятие энергии ионизации. В каком ряду энергия ионизации увеличивается, как это скажется на характере оксидов данных элементов?
а) B,Al, Ga б) Ge, Si, Cв) P, S, O?
Понятие энергии ионизации. В каком ряду энергия ионизации увеличивается, как это скажется на характере оксидов данных элементов?
а) Be, Mg, Ca б) Ga, Al, B в) N, O, F?
Какие элементы являются тип-аналогами:
а) Ca, Zn, Sr; б) Ge, As, Se; в) Cr, Mo, W? Укажите причины тип-аналогии.
Какие элементы являются тип-аналогами:
а) Fe, Co, Ni; б) Cr, Se, Mo; в) Zn, Cd, Hg? Укажите причины тип-аналогии.
Какие элементы являются диагональными аналогами: а) К, Zn; б) Be, Al, в) Nb, Sb? Укажите причины диагональной аналогии.
Какие элементы являются шринк-аналогами : а) Nb, Ta, б) Mn, Tc, в) Ir, Pt? Укажите причины шринк-аналогии.
Какие элементы являются шринк-аналогами: а) Zr, Nb, б) Mo, W; в) Na, K? Укажите причины шринк-аналогии.
Сила кислот будет возрастать в ряду: а) HClO, HBrO , HIO; б) HBr, HCl , HF; в) HI, HBr, HCl? Укажите причины.
Сила кислот будет возрастать в ряду: а) H2S, H2Se , H2Te; б) HBr, HCl , HF; в) HCl, H2S, H3P? Укажите причины.
Ионный характер гидридов увеличивается в ряду: а) Sе, S, O; б) Mg, Ca, Sr; в) Cs,Rb,K Укажите причины.
Ионный характер гидридов уменьшается в ряду: а) Na, K, Rb; б) C, B, Be; в) Y, Zr, Nb? Укажите причины.
Понятие электроотрицательности элементов. В каком ряду электрооотрицательность увеличиваются:
а) Сl, S, P б) Ge, Sn, Pb в) As, Se, Br?
Водород
С
позиций строения атома (1s1)
объяснимо положение водорода в
периодической системе. Атом водорода
имеет один электрон, который может быть
отдан атомам других элементов. Поскольку
это свойство проявляют атомы всех
элементов, начинающих периоды,— Li, Na,
К, Rb, Сs, Fr, то и водород должен стоять в
главной подгруппе I группы. С другой
стороны, поскольку атом водорода обладает
способностью, подобно атомам галогенов,
присоединять один электрон (Н+![]() =Н-),
то есть проявляет неметаллические
свойства, он должен находиться в главной
подгруппе VII группы. Такая двойственность
в химическом поведении водорода является
причиной того, что его помещают в двух
подгруппах. При этом в одной из подгрупп
символ элемента заключают в скобки.
=Н-),
то есть проявляет неметаллические
свойства, он должен находиться в главной
подгруппе VII группы. Такая двойственность
в химическом поведении водорода является
причиной того, что его помещают в двух
подгруппах. При этом в одной из подгрупп
символ элемента заключают в скобки.
Вопросы для самоподготовки
Строение атома водорода, изотопы водорода.
Какие значения степени окисления, координационного числа, валентности, эффективного заряда, кратности связей может проявлять водород в соединениях? Привести примеры.
Почему водород может быть отнесен и к 1-й и к 7-й группам? (По типу химических связей, по химическим и физическим свойствам.)
Способы получения водорода. Как выделить водород из смеси газов?
В чем причина низких температур плавления и кипения Н2 и очень малой его растворимости и в воде, и в органических растворителях?
Почему водород наилучшим образом отвечает требованиям, предъявляемым к современному топливу? Как на практике приготовить гремучую смесь? Почему необходимо соотношение 2:1?(Объемное или массовое?)
Как получить в качестве реагента атомарный водород?
Химические свойства водорода.
Техника безопасности при работе с водородом.

 s22s22p2
s22s22p2 иповые
аналоги
иповые
аналоги лоевые
аналоги
лоевые
аналоги

 2s
2p
B=2
2s
2p
B=2



