
- •«Неорганическая химия» Часть II
- •Общие методические рекомендации по изучению дисциплины
- •Содержание дисциплины
- •Тема 8 Периодический закон и периодическая таблица д.И.Менделеева.
- •Тема 9 Водород
- •Тема 10. Галогены
- •Тема 11. Элементы via группы периодической системы
- •Тема 12 Элементы va группы периодической системы
- •Тема 13. Подгруппа углерода
- •8. Периодический закон и периодическая таблица д.И.Менделеева.
- •Контрольные задания
- •10. Галогены
- •Вопросы для самоподготовки
- •Вопросы для самоподготовки
- •Кислородные соединения азота
- •15.3. Углерод
- •15.4. Кремний
- •15.5. Олово (Sn)
- •Тема 15. Вторая группа периодической системы
- •«Щелочные металлы»
- •Контрольные задания
- •Тема 17 Элементы побочных подгрупп периодической системы, d-металлы.
15.5. Олово (Sn)
Латинское название элемента: Stannum Олово было известно древним цивилизациям. В природе встречается в основном в виде минерала касситериата (оловянный камен) - SnO2. Порядковый номер: 50 Относительная атомная масса: 118.710 Олово - серебристо-белый металл, обладающий высокой ковкостью. Температура плавления: 219.9С
Электроотрицательность элемента: 1.72
В обычных условиях химически стоек к действию кислорода, кислот, щелочей. 15.6. Свинец (Pb)
Латинское название элемента: Plumbum. Свинец был известен еще древним цивилизациям. Встречается в природе в виде минерала галенита(свинцового блеска) PbS. Порядковый номер: 82 Относительная атомная масса: 207.21 Свинец -мягкий, пластичный тускло-серый металл. Температура плаления: 327.4С В соединениях проявляет степень окисления +2, +4. Электроотрицательность элемента: 1.55
Все растворимые соединения свинца ядовиты!
Вопросы для самоподготовки
Чем объясняется адсорбционная способность угля?
Сравнить химическую активность углерода и кремния при действии на них концентрированной HNO3,
Сравнить химическую активность углерода и кремния при действии на них концентрированного NaOH.
Почему кремний растворяется в смеси концентрированных HNO3 и HF. Идет ли растворение кремния в "царской водке"? Почему?
Соединения углерода и кремния с металлами. Получение и классификация.
Получение оксидов углерода и кремния. Их устойчивость в степени окисления +2, +4.
Чем ограничено применение СО2 в качестве огнетушительного средства?
Получение гидроксидов углерода и кремния. В чем их принципиальное различие?
Какая кремневая кислота существует в сильно разбавленных растворах, что происходит при концентрировании?
Почему при хранении раствора щелочи в стеклянной посуде, он мутнеет?
Изменение кислотно-основных свойств в ряду гидроксидов Ge, Sn и Pb.
Контрольные задания
Расположить соли KCN, KCNO, KCNS в ряд снижения рН их растворов (одинаковой молярной концентрации).
Сравнить кислотно-основные и окислительно-восстановительные свойства оксида углерода (II) и оксида углерода (IV), исходя из строения их молекул. Привести примеры. Написать уравнения соответствующих реакций.
Рассчитать необходимую массу сырья (какого?) для производства 478 кг стекла, состав которого можно описать формулой Na2O..CaO.6SiO2
При сгорании 10 г графита выделилось 330,4 кДж теплоты, 1 г алмаза—32,94 кДж, а 1,5 г карбина—45 кДж. Рассчитайте теплоты сгорания алмаза, графита и карбина. Какое из аллотропных видоизменений углерода наиболее стабильно в обычных условиях?
Растворимость углекислого газа при 20 °С составляет 0,88 объемов в 1 объеме воды. Рассчитайте максимально возможную массовую долю угольной кислоты в растворе исходя из предположения, что весь оксид углерода (IV) взаимодействует с водой.
На нейтрализацию раствора карбоната и гидрокарбоната натрия потребовался раствор гидроксида натрия объемом 80 мл с концентрацией 1 моль/л. После упаривания нейтрализованного раствора выпал осадок Ма2СОз- 10Н2О массой 16,09 г. Определите массовые доли (%) карбоната и гидрокарбоната в растворе.
Сравнить химическую активность углерода и кремния при действии на них концентрированной HNO3, концентрированного NaOH.
Смесь карбонатов натрия и калия массой 7 г обработали серной кислотой, взятой в избытке. При этом выделилось 1,344 л (н.у.) газа. Определить массовые доли (%) карбонатов в исходной смеси
Какую массу воды необходимо пропустить над раскаленным углем для получения 10 м3 водяного газа, содержащего С02 и Н2 в объемных отношениях 1:1?
С целью регенерации олова луженые железные пластинки, имеющие поверхность общей площадью 170 м2 и толщину покрытия 1,5-10-4 м (r(Sn)=6,5 г/см3), прокипятили с раствором NaOH; при этом выделился газ объемом 25 м3 (н. у.). Далее олово восстановили. Считая, что восстановление произошло полностью, рассчитайте долю практического выхода олова от теоретически возможного. Предложите способы восстановления олова.
Вычислить %-ное содержание углерода, азота и водорода в веществе, если при сжигании 0,18 г его было получено 0,132 г CO2 , 0,108 г H2O и выделилось 67,2 мл N2 (н.у.)
До какого объема нужно разбавить 30% раствор нитрата свинца (II) объемом 25 мл (r=1,33 г/смз), что бы получить раствор соли с концентрацией 0,2 моль/л ((r=1,08 г/смз)?
Сколько мл 0,5 н раствора гидроксида калия ((r=1,43 г/смз) потребуется для растворения кремния, образовавшегося при прокаливании 5 г песка с 5 г магния?
Можно ли получить 1н. раствор H2CO3? Подтвердить ответ расчетом, имея в виду, что в 1 объеме воды при 20 0С растворяется 0,88 объема СО2
Навеску смеси кремния и песка обработали раствором щелочи. При этом выделился газ объемом 11,2 л (н. у.). Осадок тщательно промыли водой, растворили в избытке плавиковой кислоты. Получили раствор, содержащий 13,83 г кремнефто-ристоводородной кислоты. Определите массу исходной смеси.
Песок массой 500 кг сплавили с гидроксидом кальция. Получили 800 кг силиката кальция. Какова доля (%) практического выхода готового продукта к теоретически возможному?
Какую массу Na2SiO4.9H2O нужно взять для приготовления 200 мл 0.5 н раствора (ρ=1,35 г|cм3) в расчете на безводную соль?
Через порошок кремния массой 5 г пропустили ток сероводорода при 1300 °С. При этом образовался дисульфид кремния SiS2. Какой газ и в каком объеме (н. у.) образовался при этом? Напишите уравнение реакции гидролиза SiS2.
При сплавлении 10 г карбоната калия с оксидом алюминия получена соль, содержащая 39,8% К, 27,55% А1, 32,65% 0. Определите формулу и массу полученного соединения.
Какой объем (н. у.) ацетилена получен из 500 кг карбида кальция, содержащего 7% примесей, если отношение практического выхода ацетилена по отношению к теоретическому составляет 99,2%?
Кварцевый песок массой 50 г сплавили с коксом в дуговой печи. Каковы масса полученного вещества и объем выделившегося газа?
Сравнить по степени гидролизуемости соседние вещества в ряду: SnCl2, SnCl4, Na2SnO3, Na2SnO2.
Какие из реакций можно использовать для получения SnO (при нагревании): Sn+O2®; Sn(OH)2
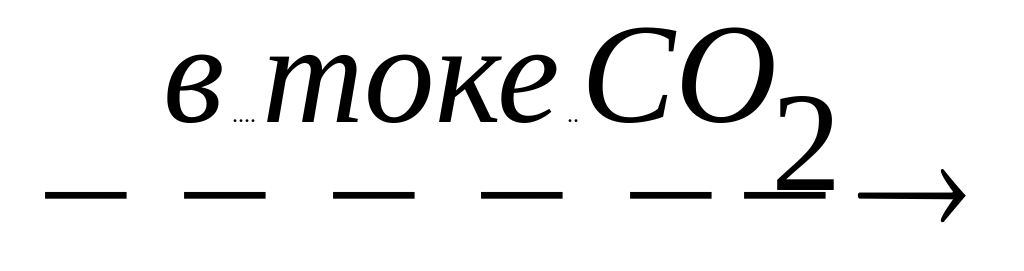 ;
Sn(OH)2
;
Sn(OH)2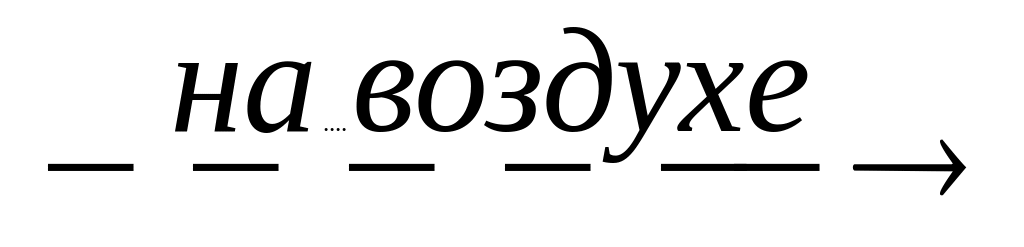 ;
Sn(NO3)2
;
Sn(NO3)2 ;
SnC2О4
;
SnC2О4
;
SnO2
+ CO
®.
;
SnC2О4
;
SnC2О4
;
SnO2
+ CO
®.Что произойдет, если в раствор SnCl2 опустить пластинку Zn?
Почему в IV группе, как ни в какой другой элементам свойственна амфотерность? Приведите факты, доказывающие металличность даже углерода и неметалличность свинца.
Оцените термодинамическую возможность получения германия из GeO2 путем восстановления его магнием, водородом, алюминием при стандартных условиях: DH0обр(Ge02)=537,9 кДж/моль; DS0обр(Ge02)=52,125 Дж/моль.К; DG0обр(Al2O3) =-1583,3 кДж/моль; DG0обр(MgO) = -569, 6 кДж/моль; DG0обр(H2O)=-237,4 кДж/моль.
Сравните свойства α- и β- оловяных кислот.
Через порошок кремния массой 5 г пропустили ток сероводорода при 1300 °С. При этом образовался дисульфид кремния SiS2. Какой газ и в каком объеме (н. у.) образовался при этом? Напишите уравнение реакции гидролиза SiS2.
Расположить соли KCN, KCNO, KCNS в ряд снижения рН их растворов (одинаковой молярной концентрации).
Почему кремний растворяется в смеси концентрированных HNO3 и HF. Идет ли растворение кремния в "царской водке"? Почему?
Элементы IIIА группы периодической системы
Вопросы для самоподготовки
Общая характеристика р-элементов III группы.
Нахождение в природе B,Al,Ga,Yn,Ta
Получение Al
Физические свойства р-элементов III группы.
Применение простых веществ.
Характерные степени окисления р-элементов III группы.
Взаимодействие с простыми веществами, с водой, с кислотами, щелочами.
Взаимодействие B,Al,Ga,Yn,Ta с оксидами и солями.
Алюмотермия.
Соединения с металлами B,Al. Свойства. Применение.
Водородные соединения р-элементов III группы. Их структурные особенности. Получение, свойства, применение. Гидридокомплексы.
Кислородные соединения р-элементов III группы. Получение, модификации.
Корунд. Свойства и применение.
Гидроксиды B,Al,Ga,Yn,Ta. Их применение. Получение, структура, физические и химические свойства.
Соли р-элементов III группы. Комплексные соли. Их растворимость.
Бура: структура, свойства, применение.
Нитриды. Боразон. Боразол. Галиды. Их устойчивость, структура, получение, свойства, применение.
Комплексные соли B,Al,Ga,Yn,Ta.
Особенности соединений с фтором.
Контрольные задания
Бор массой 10 г обработали концентрированной азотной кислотой. Выпал белый осадок. Определите массу полученного осадка.
Какое количество борной кислоты можно получить из 20 г аморфного бора при окислении его 65%-ным раствором азотной кислоты, если последнего добавлено 50 мл (ρ=1,4 г/см3) и HNO3 восстанавливается до NO.
Какой объем раствора NaOH с массовой долей 25% (р= 1,269 г/см3) необходим для нейтрализации борной кислоты массой 0,5 кг? Определите массу образующейся соли.
Определите тепловой эффект реакции горения бора, если при сгорании аморфного бора массой 43,24 г выделилось 2508 кДж теплоты.
Алюминий массой 4 г провзаимодействовал с гидроксидом калия массой 8,3 г и водой массой 13,3 г. Определите массу образовавшейся соли и объем выделившегося водорода.
По стандартным энтальпиям образования рассчитайте тепловые эффекты сгорания в кислороде следующих веществ: В2Н6, В4Н10 и Si2H6 (назовите эти вещества, напишите графические формулы) (DH0обр соответственно равны 30,75 ; 82,98; 78,31 кДж/моль) Проанализируйте возможность использования этих веществ как топлива.
Сколько кг борной кислоты и какой объем 23 %-ного раствора Na2CO3 (ρ=1,25 г|cм3) необходимо затратить для получения 1 т. буры ?
. К насыщенному при 60 °С раствору буры массой 88 г прилили 8% раствор соляной кислоты объемом 23 мл (ρ=1,039 г/см3) и оставили на сутки. Определите массу борной кислоты, выпавшей в осадок, если температура раствора понизилась до 10°С (Растворимость данной соли при 60 0С =17.50 г в 100 г воды, а при 10 0С = 1,60 г в 100 г воды)
Оцените возможность растворения алюминия в кислотах, воде, щелочах на основании значений стандартных электродных потенциалов полуреакций:
А102- +2Н20+Зе- =А1+40Н-; Е°=-2,35 В Аl3+ +Зe-= Al E°==-1,663В
Охарактеризуйте коррозионную устойчивость алюминия в этих средах и на воздухе.
При сплавлении 10 г карбоната калия с оксидом алюминия получена соль, содержащая 39,8% К, 27,55% А1, 32,65% 0. Определите формулу и массу полученного соединения.
Напишите уравнения реакций, иллюстрирующих амфотерные свойства оксидов и гидроксидов галлия (III) и индия (III)
При взаимодействии оксида алюминия массой 10,2 г с избытком углерода образовались 6,72 л СО и твердое кристаллическое вещество массой 7,2 г. Определите состав этого соединения и напишите уравнение реакции его получения
Сравнить кислотно-основные и окислительно-восстановительные свойства оксида углерода (II) и оксида углерода (IV), исходя из строения их молекул. Привести примеры. Написать уравнения соответствующих реакций.
Дописать уравнение реакции и расставить коэффициенты, назвать все соединения
Al + HNO3 конц. → Al + HNO3 разб. →
Нитриды бора Получение, свойства. Боразон, боразол.
При сплавлении 10 г карбоната калия с оксидом алюминия получена соль, содержащая 39,8% К, 27,55% А1, 32,65% 0. Определите формулу и массу полученного соединения.
Химические свойства бора.
Оксиды бора и алюминия. Модификации. Получение. Применение. Физические и химические свойства.
Напишите уравнения реакций, иллюстрирующих амфотерные свойства оксидов и гидроксидов галлия (III) и индия (III)
. К насыщенному при 60 °С раствору буры массой 88 г прилили 8% раствор соляной кислоты объемом 23 мл (ρ=1,039 г/см3) и оставили на сутки. Определите массу борной кислоты, выпавшей в осадок, если температура раствора понизилась до 10°С (Растворимость данной соли при 60 0С =17.50 г в 100 г воды, а при 10 0С = 1,60 г в 100 г воды)
Сколько кг борной кислоты и какой объем 23 %-ного раствора Na2CO3 (ρ=1,25 г|cм3) необходимо затратить для получения 1 т. буры ?
Оксобораты, их строение и свойства.
Алюминий массой 4 г провзаимодействовал с гидроксидом калия массой 8,3 г и водой массой 13,3 г. Определите массу образовавшейся соли и объем выделившегося водорода.
Дописать уравнения реакций и расставить коэффициенты, назвать все соединения:
BF3 +NH3→; Al2(CO3)3 +H2O→; AlCl3+H2O→
Привести примеры, иллюстрирующие склонность атомов бора и алюминия к комплексообразованию.
По стандартным энтальпиям образования рассчитайте тепловые эффекты сгорания в кислороде следующих веществ: В2Н6, В4Н10 и Si2H6 (назовите эти вещества, напишите графические формулы) (DH0обр соответственно равны 30,75 ; 82,98; 78,31 кДж/моль) Проанализируйте возможность использования этих веществ как топлива.
Охарактеризовать соединение – Al2O3 (название, графическая формула, свойства)
Охарактеризовать соединение – B2O3 (название, графическая формула, свойства)
Охарактеризовать соединение – H3BO3 (название, графическая формула, свойства)
Охарактеризовать соединение – Al(OH)3 (название, графическая формула, свойства)
