
- •Электролиз в гидрометаллургии. Теоретические основы
- •Оглавление
- •Введение
- •1. Структура и свойства электролитических осадков гидрометаллургии
- •1.1 Требования к качеству металла
- •1.2. Связь структуры осадка с его качеством
- •1 Структура электролитических осадков
- •2Включение в катодный осадок неметаллических примесей.
- •1.3 Требования к параметрам электролиза
- •3. Особенности электродных процессов гидрометаллургии
- •3.1Равновесные потенциалы металлов и диаграмма устойчивости воды.
- •2.2 Равновесные потенциалы мультивалентных металлов
- •2.3 Бестоковые потенциалы металлов
- •2.4 Катодный процесс
- •3. Параллельные катодные реакции
- •3.1 Общие положения теории совместного разряда. Необходимые и достаточные условия
- •3.2. Распределение тока между реакциями
- •3.3. Совместный разряд ионов металла и водорода
- •3.4. Cовместный разряд ионов целевого металла и примесей
- •4Основные положения теории электрокристаллизации металлов
- •4.1Образование зародышей и центров кристаллизации
- •4.2 Кинетика зародышеобразования
- •4.3 Скорость роста зародышей.
- •4.4Физические модели формирования катодных осадков
- •5 Формирование двумерных (2d) структур
- •6 Формирование трехмерных (3d) структур
- •6.1 Динамика формирования катодного осадка
- •6.2Влияние параметров электролиза на микроструктуру осадка
- •7Микрораспределение тока и металла по поверхности катода
- •7.1 Критерии устойчивости роста
- •7.2Влияние режимов электролиза на устойчивость фронта роста осадка
- •8 Морфология осадков, получаемых при ограничении массопереноса
- •8.1 Электролиз на предельном токе диффузии.
- •8.2 Образование сферолитов
- •8.3 Микрораспределение тока и металла при пассивировании поверхности катода
- •Литература
2.4 Катодный процесс
Катодной реакцией при электролитическом получении любого металла является восстановление ( разряд) его гидратированных ионов до элементного состояния :
Меn+ + ne = Mе0 (2.9)
Отличие электродной реакции (2.9) от реакций других промышленных электрохимических систем состоит в следующем. Продукт реакции - металл, обладает кристаллической структурой и имеет определенную форму (плотный металл, воспроизводящий геометрию подложки, разрозненные кристаллиты древовидной формы, порошки). То есть реакция (2.9), по которой получаются атомы металла, протекает одновременно с формированием кристаллической микроструктуры и макроскопической морфологии катодного осадка, получаемого из этих атомов. Такое объединение двух различающихся своей физико-химической сутью процессов приводит к зависимости структуры получаемого металла и, следовательно, его потребительских свойств, к условиям осуществления реакции (2.9). Поэтому катодный процесс иногда, не совсем точно, именуется процессом электрокристаллизации.
Более правильно катодный процесс следует понимать не как электрохимическую реакцию, а как двухстадиальный процесс, в котором объединяются две стадии. Первая- реакция восстановления ионов металла с образованием разрозненных атомов металла (ад атомы), вторая- объединение ад –атомов в кристаллическую структуру. Обе стадии протекают одновременно, но в разных точках поверхности, а так как поверхность катода эквипотенциальна, то перенапряжение при электрохимическом выделении металлов включает перенапряжение самой реакции (hp) и ,так называемое, фазовое перенапряжение (hk), требуемое для образования и роста катодного осадка. Понятно, что, так же как и при других электродных реакциях, суммарное перенапряжение зависит от плотности тока, увеличиваясь вместе с ней. Однако в данном случае характер этой зависимости часто оказывается более сложным. Даже при осаждении одного и того же металла результаты поляризационных измерений могут укладываться в зависимости от диапазона применяемых плотностей тока, состава раствора и температуры на прямые в одной из следующих систем координат:
h - J; h - lgJ; h =a +blgJ
Наличие фазового перенапряжения иллюстрируют кривые изменения потенциала катода от времени после включения тока, полученные при выделении серебра из раствора AgNO3 на инертном катоде (А.Г. Самарцев) рисунок 2.5.
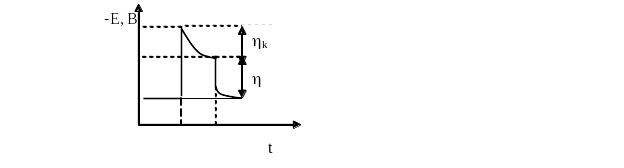
Рис.2.5 Изменение потенциала катода во времени при осаждении серебра на чужеродную подложку
В момент включения тока, потенциал резко смещается в отрицательную сторону, а затем более медленно возвращается к постоянному значению. Разность между максимальным и установившимся значениями потенциала (hк) представляет собой фазовое перенапряжение, требуемое на образование зародышей серебра. После отключения тока, повторное его включение дает такую же зависимость катодного потенциала от времени. Микроскопическое наблюдение поверхности электрода выявило образование микрокристаллических частиц серебра в точке максимума кривой потенциал – время. В дальнейшем, аналогичные факты были получены и для других металлов.
Следующей особенностью является высокая чувствительность процесса к ионному составу электролита и наличию в нем молекул соединений, способных адсорбироваться металлом. Проявляется она как в изменении скорости реакции, так и в макро и микроструктуре осадка. Еще в 1917г Н.А. Изгарышевом был выявлен факт уменьшения перенапряжения в следующем ряду анионов солей металлов:
ClO4- > SO42- > CH3COO- > Cl - > NO3- > Br - > S2-.
Присутствие в растворе, помимо ионов разряжающегося металла, «индифферентных» катионов, таких как Na+. Mg2+, Al3+ увеличивает перенапряжение. Подобные эффекты наблюдались при выделении никеля, цинка, меди и других металлов. В промышленных электролитах, содержащих серную кислоту, посторонними катионами являются водородные ионы. Увеличение их концентрации приводит чаще всего к росту перенапряжения.
Обнаруженная М. А. Лошкаревым адсорбционная поляризация проявляется в том, что при добавлении к раствору некоторых поверхностно-активных веществ (например, трибензиламина) изменяется скорость выделения металла на ртутном и на твердых катодах. Она становится, во-первых, меньше той, что наблюдалась до введения добавки, и, во-вторых, не зависящей в широкой области потенциалов от катодного потенциала. Однако после того как достигается определенный (обычно весьма отрицательный) потенциал, действие добавки прекращается. Скорость выделения начинает быстро расти, приближаясь к нормальному для этих условий значению, отвечающему предельному диффузионному току (рисунок 2.6).
i.mA
33
1
0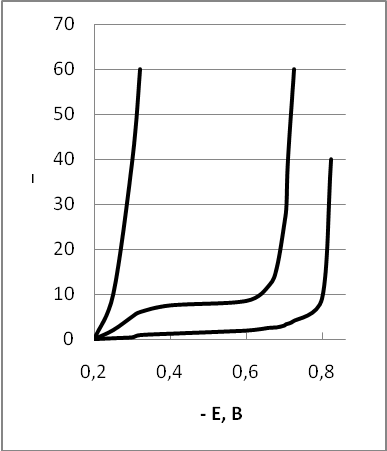
Рис.2.6 Влияние добавок на кинетику восстановления ионов олова из сульфатных растворов: без добавок (1), с добавками aнафтола (2) и a нафтола + желатина (3)
Сопоставление результатов поляризационных измерений на ртутных катодах с электрокапиллярными кривыми и кривыми дифференциальной емкости (снятыми до и после введения добавки) показали, что потенциал, при котором прекращается действие добавки, совпадает с потенциалом ее десорбции.
Действие добавки оказывается при этом специфическим. Одни и те же добавки или определенная их комбинация в разной степени тормозят разряд различных ионов на ртутном катоде. Явление адсорбционной поляризации широко используется для улучшения качества осадков, в процессах гидрометаллургии широко используются добавки различных ПАВ для выравнивания поверхности осадков (медь, цинк, олово).
Все промышленно получаемые металлы, по величине перенапряжения при одной и той же плотности тока, можно разделить на три группы. К первой из них относятся металлы, выделяющиеся из водных растворов с очень малым перенапряжением, не превышающим при обычных плотностях тока тысячных долей вольта (ртуть, серебро, таллий, свинец, кадмий, олово). Для этой группы металлов (кроме ртути) наиболее отчетливо проявляется неустойчивость потенциала во времени, При промышленных плотностях тока эти металлы дают грубошираховатые осадки. Токи обмена для металлов этой группы очень велики. Так, например, ток обмена между металлической ртутью и раствором ее нитрата превышает 103 А/м2, а между серебром и раствором нитрата серебра достигает 102 А/м2.
Висмут, медь, цинк образуют вторую, промежуточную, группу. Для нее характерно металлическое перенапряжение порядка нескольких десятков милливольт, образование более тонких осадков и меньшие, чем у металлов предыдущей группы, токи обмена. Для меди, например, ток обмена в контакте с раствором сульфата меди близок к 10 А/м2.
Наибольшим металлическим перенапряжением обладают металлы третьей группы (железо, никель, кобальт) у которых оно достигает нескольких десятых долей вольта. Эти металлы выделяются на катоде в виде плотных тонкокристаллических осадков. Токи обмена у них малы, составляя для железа и никеля в растворах их сульфатов соответственно 10-4 и 10-5 А/м2.
Опытами с использованием монокристаллов была установлено различие в перенапряжении осаждении металлов каждой группы, на плоскостях граней с различными индексами (повышается с уменьшением индекса). Однако, значение перенапряжения в большей степени определяется природой металла, чем кристаллографической ориентацией электродной поверхности. Независимо от того, на какой из граней происходит выделение металла, перенапряжение всегда выше для никеля, чем для меди, а для меди оно всегда больше, чем для олова или свинца.
Как уже указывалось, электродная поляризация, наблюдаемая при выделении металлов, может быть связана либо с фазовыми превращениями и представлять собой один из видов фазового перенапряжения, либо с электрохимическим перенапряжением, которое, растворах гидрометаллургии, где отсутствуют комплексообразующие соединения, вероятнее всего является перенапряжением стадии разряда – ионизации. Преобладание того или иного вида перенапряжения определяется природой металла, составом раствора, плотностью тока, температурой электролита.
Выделение металлов, стоящих в начале ряда (Hg, Ag, Tl, Pb, Cd, Sn), сопровождается лишь незначительной поляризацией, связанной главным образом с замедленностью возникновения и развития новой фазы. Замедленность электрохимической стадии не играет здесь существенной роли. В электрохимической литературе эти металлы, для которых характерно фазовое перенапряжение, называются часто нормальными металлами. Напротив, при выделении металлов, стоящих в конце ряда табл. 2.1 (металлы группы железа), наблюдается высокая поляризация; обусловленная преимущественно замедленностью электрохимической стадии. Эти металлы, для которых характерно электрохимическое перенапряжение, называются инертными металлами. Промежуточное положение и по величине поляризации, и по природе перенапряжения (здесь наиболее вероятно наложение нескольких видов перенапряжения) занимают такие металлы, как Bi, Си и Zn.
Это различие в величине и механизме перенапряжения обусловливает, согласно Фольмеру, различный характер осадков, в виде которых нормальные и инертные металлы выделяются па катоде. Все факторы, вызывающие торможение акта разряда, должны, с этой точки зрения, уменьшать относительную роль кристаллизационных явлений и приводить к получению равномерных мелкозернистых осадков. Увеличение торможения достигается или переводом простых ионов в более прочные комплексы, или при помощи добавок поверхностно-активных веществ (если их адсорбция больше всего сказывается на акте разряда). Изменение структуры осадков, наблюдаемое при переходе от простых электролитов к цианистым, а также характер электроосаждения в условиях адсорбционной поляризации подтверждают эту точку зрения.
Наглядным подтверждением этого вывода являются опыты, выполненные А.Т. Ваграмяном, по влиянию температуры на поляризацию и структуру осадков инертных металлов, в частности никеля. Было показано, что увеличение температуры до 1800С резко снижает катодное перенапряжение, устраняет ее зависимость от рН. (рис. 2.7), структура никеля при этом существенно изменяется. Металл кристаллизуется с формированием крупных зерен с грубошераховатой поверхностью. Объясняется этот факт тем, что высокая температура устраняет адсорбцию ионов или молекул, тормозящих стадию разряда ионов никеля. По абсолютной величине катодное перенапряжение никеля становится близким к перенапряжению металлов первой группы.
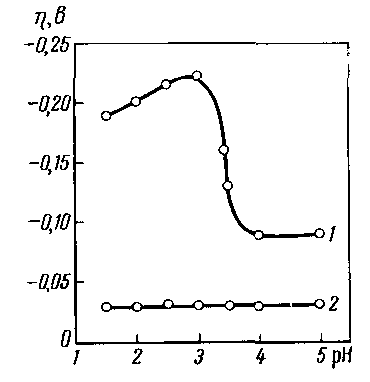
Рис2.7 Влияние температуры на перенапряжение, раствор
1н NiSO4, температура (С0): 1-50, 2- 180,J=10 Acм-2
