
- •Электролиз в гидрометаллургии. Теоретические основы
- •Оглавление
- •Введение
- •1. Структура и свойства электролитических осадков гидрометаллургии
- •1.1 Требования к качеству металла
- •1.2. Связь структуры осадка с его качеством
- •1 Структура электролитических осадков
- •2Включение в катодный осадок неметаллических примесей.
- •1.3 Требования к параметрам электролиза
- •3. Особенности электродных процессов гидрометаллургии
- •3.1Равновесные потенциалы металлов и диаграмма устойчивости воды.
- •2.2 Равновесные потенциалы мультивалентных металлов
- •2.3 Бестоковые потенциалы металлов
- •2.4 Катодный процесс
- •3. Параллельные катодные реакции
- •3.1 Общие положения теории совместного разряда. Необходимые и достаточные условия
- •3.2. Распределение тока между реакциями
- •3.3. Совместный разряд ионов металла и водорода
- •3.4. Cовместный разряд ионов целевого металла и примесей
- •4Основные положения теории электрокристаллизации металлов
- •4.1Образование зародышей и центров кристаллизации
- •4.2 Кинетика зародышеобразования
- •4.3 Скорость роста зародышей.
- •4.4Физические модели формирования катодных осадков
- •5 Формирование двумерных (2d) структур
- •6 Формирование трехмерных (3d) структур
- •6.1 Динамика формирования катодного осадка
- •6.2Влияние параметров электролиза на микроструктуру осадка
- •7Микрораспределение тока и металла по поверхности катода
- •7.1 Критерии устойчивости роста
- •7.2Влияние режимов электролиза на устойчивость фронта роста осадка
- •8 Морфология осадков, получаемых при ограничении массопереноса
- •8.1 Электролиз на предельном токе диффузии.
- •8.2 Образование сферолитов
- •8.3 Микрораспределение тока и металла при пассивировании поверхности катода
- •Литература
2.3 Бестоковые потенциалы металлов
Рассмотрим вопрос о величинах потенциалов, устанавливающихся на металле, при его контакте с электролитом в обычных атмосферных условиях в отсутствии тока.
Начнем с металлов первой группы. Кислые электролиты имеют рН < 5,0 поэтому в такой системе должна протекать реакция взаимодействия металла с ионами водорода:
Ме + 2Н+ = Ме2+ + Н2, (2.8),
которая по существу является суммой 2-х реакций:
катодной: 2Н+ +2е = Н2
анодной: Ме -2е = Ме2+
Потенциал электрода примет такое значение, при котором скорости (плотности тока) обеих реакций будут одинаковыми (рис. 2.2). Величина этого потенциала (называемого компромиссным) отрицательнее потенциала водородного электрода и положительнее потенциала металла. Она определяется ходом поляризационных кривых обеих реакций и, следовательно, зависит от всех параметров определяющих этот ход. Так, например, на скорость выделения водорода при электролизе цинка существенно влияет наличие примесей в растворе, на скорость окисления цинка примеси не влияют. Тогда в растворах, содержащих примеси, компромиссный потенциал цинка будет выше (кривая 2, рис.2.3), чем в чистом растворе. Важно отметить, что отличие компромиссного потенциала от равновесного состоит в его не стационарности вследствие изменения концентраций ионов металла и водорода в растворе во времени.
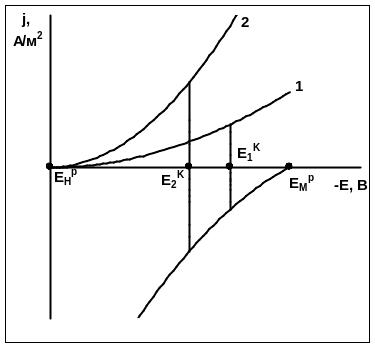
Рис. 2.3. Бестоковые потенциалы электроотрицательных металлов
Для металлов второй группы должна наблюдаться сходная ситуация. Вследствие контакта электролита с кислородом воздуха на электроде создается возможность протекания реакции окисления металла кислородом:
Me +0,5O2 + 2H+ = Me2+ + H2O,
которая является суммой двух реакций:
катодной (восстановление кислорода): 0,5O2 + 2H+ +2е = H2O
и анодной (окисление металла): Ме -2е = Ме2+ .
Поэтому на электроде создается компромиссный потенциал больше равновесного потенциала металла и меньше потенциала кислорода. Отличие этого случая от первого состоит в том, что из - за низкой концентрации кислорода в растворе он восстанавливается на предельном токе диффузии с не значительными скоростями, компромиссный потенциал близок к равновесному потенциалу металла (рис 2.4).

Рис.2.4 Бестоковые потенциалы электроположительных металлов.
Для металлов третьей группы равновесие с собственными ионами так же не достижимо. В этом случае должна протекать реакция окисления воды ионами металла:
Me2+ + H2O = Me +0,5O2 + 2H+,
которая так же является суммой двух реакций:
катодной (восстановление ионов металла) Ме2+ +2е = Ме
и анодной (окисление воды) H2O -2е = 0,5O2 + 2H+
Компромиссный потенциал должен имеет величину между потенциалом металла и кислорода.
