
- •Электролиз в гидрометаллургии. Теоретические основы
- •Оглавление
- •Введение
- •1. Структура и свойства электролитических осадков гидрометаллургии
- •1.1 Требования к качеству металла
- •1.2. Связь структуры осадка с его качеством
- •1 Структура электролитических осадков
- •2Включение в катодный осадок неметаллических примесей.
- •1.3 Требования к параметрам электролиза
- •3. Особенности электродных процессов гидрометаллургии
- •3.1Равновесные потенциалы металлов и диаграмма устойчивости воды.
- •2.2 Равновесные потенциалы мультивалентных металлов
- •2.3 Бестоковые потенциалы металлов
- •2.4 Катодный процесс
- •3. Параллельные катодные реакции
- •3.1 Общие положения теории совместного разряда. Необходимые и достаточные условия
- •3.2. Распределение тока между реакциями
- •3.3. Совместный разряд ионов металла и водорода
- •3.4. Cовместный разряд ионов целевого металла и примесей
- •4Основные положения теории электрокристаллизации металлов
- •4.1Образование зародышей и центров кристаллизации
- •4.2 Кинетика зародышеобразования
- •4.3 Скорость роста зародышей.
- •4.4Физические модели формирования катодных осадков
- •5 Формирование двумерных (2d) структур
- •6 Формирование трехмерных (3d) структур
- •6.1 Динамика формирования катодного осадка
- •6.2Влияние параметров электролиза на микроструктуру осадка
- •7Микрораспределение тока и металла по поверхности катода
- •7.1 Критерии устойчивости роста
- •7.2Влияние режимов электролиза на устойчивость фронта роста осадка
- •8 Морфология осадков, получаемых при ограничении массопереноса
- •8.1 Электролиз на предельном токе диффузии.
- •8.2 Образование сферолитов
- •8.3 Микрораспределение тока и металла при пассивировании поверхности катода
- •Литература
3. Особенности электродных процессов гидрометаллургии
3.1Равновесные потенциалы металлов и диаграмма устойчивости воды.
Вода с электрохимической точки зрения не является инертной средой, ее молекулы могут окисляться и восстанавливаться на металлических электродах с образованием молекулярного водорода и кислорода. Кроме того аналогичные окислительные и восстановительные реакции протекают с участием ионов водорода или гидроксил ионов, когда их концентрация превосходит 10-7 (равновесная концентрация при диссоциации воды), и молекулярного кислорода, всегда присутствующего в электролитах.
Учитывая, что эти реакции могут протекать параллельно с целевой реакцией Men+ + ne = Me0 , необходимо сопоставить потенциалы целевой реакции с потенциалами реакций воды. Ими являются потенциалы водородного и кислородного электродов. Реакции для этих электродов и их потенциалы показаны ниже.
Водородный электрод
В кислых растворах
2Н+ +2е = Н2
В нейтральных растворах
2Н2О +2е = Н2 + 2ОН-
Равновесный потенциал водородного электрода равен
![]()
![]()
Или при температуре 250 и давлении водорода 1атм
Е =- 0,59рН (2.1)
Кислородный электрод
В кислых и нейтральных растворах
0,5О2 + 2Н+ +2е = Н2О
Равновесный потенциал кислородного электрода
![]()
![]()
Для стандартных условий
Ео = 1,23 - 0,059рН (2.2)
График уравнений (2.1) и (2.2), получивший название диаграммы электрохимической устойчивости воды показан на рис. 2.1.
На нем можно выделить три области. Первая - до прямой водородного электрода. В этой области вода или ионы водорода восстанавливается до молекулярного водорода. Вторая область – между водородной и кислородной прямыми отвечает устойчивому состоянию, когда вода ни окисляться, ни восстанавливаться не может. Третья область – за кислородной прямой. В ней вода или гидроксил ионы окисляются до кислорода.
В соответствие с областями диаграммы и величинами собственных стандартных потенциалов, все металлы можно разделить на три группы.
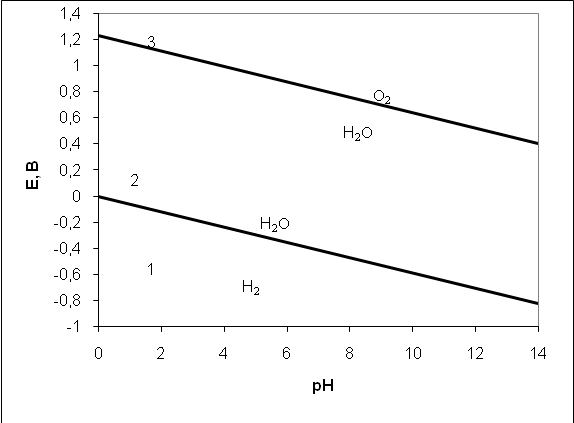
Рис.2.1 Диаграмма электрохимической устойчивости воды
Первая - электроотрицательные металлы, то есть металлы, потенциалы которых отрицательнее потенциалов водородного электрода. К ним относятся (табл.2.1):
Табл.2.1. Электроотрицательные металлы
металл |
Mn |
Zn |
Fe |
Cd |
Tl |
Ni |
Co |
Sn |
Pb |
Е0, В |
-1,10 |
-0,76 |
-0,44 |
-0,40 |
-0,34 |
-0,24 |
-0,26 |
-0,136 |
-0,126 |
Остальные металлы считаются электроположительными.
Вторая группа представлена металлами, имеющими потенциалы второй области диаграммы. Это - Ag (E0 = +0,79B), Cu (Е0 = +0,34 В), As (E0 = +0,30 B), Bi (E0=+0,23 B), Sb (E0= +0,20B). Металлы этой группы восстанавливаются без восстановления воды или ионов водорода, однако в этой области потенциалов может восстанавливаться молекулярный кислород до воды. Ни какие реакции окисления, кроме целевой реакции, не возможны.
Третья группа образована металлами с потенциалами положительнее потенциалов кислородного электрода. Сюда входят: Au (E0=+ 1,29B), Pt (E0=+1,2B), а так же для не сильно кислых растворов- Pd ( E0=+0,98B), Ir (E0= +1,15B). Ионы металлов этой группы восстанавливаются без параллельных реакций восстановления воды или кислорода. Анодное окисление этих металлов не возможно.
