
- •Электролиз в гидрометаллургии. Теоретические основы
- •Оглавление
- •Введение
- •1. Структура и свойства электролитических осадков гидрометаллургии
- •1.1 Требования к качеству металла
- •1.2. Связь структуры осадка с его качеством
- •1 Структура электролитических осадков
- •2Включение в катодный осадок неметаллических примесей.
- •1.3 Требования к параметрам электролиза
- •3. Особенности электродных процессов гидрометаллургии
- •3.1Равновесные потенциалы металлов и диаграмма устойчивости воды.
- •2.2 Равновесные потенциалы мультивалентных металлов
- •2.3 Бестоковые потенциалы металлов
- •2.4 Катодный процесс
- •3. Параллельные катодные реакции
- •3.1 Общие положения теории совместного разряда. Необходимые и достаточные условия
- •3.2. Распределение тока между реакциями
- •3.3. Совместный разряд ионов металла и водорода
- •3.4. Cовместный разряд ионов целевого металла и примесей
- •4Основные положения теории электрокристаллизации металлов
- •4.1Образование зародышей и центров кристаллизации
- •4.2 Кинетика зародышеобразования
- •4.3 Скорость роста зародышей.
- •4.4Физические модели формирования катодных осадков
- •5 Формирование двумерных (2d) структур
- •6 Формирование трехмерных (3d) структур
- •6.1 Динамика формирования катодного осадка
- •6.2Влияние параметров электролиза на микроструктуру осадка
- •7Микрораспределение тока и металла по поверхности катода
- •7.1 Критерии устойчивости роста
- •7.2Влияние режимов электролиза на устойчивость фронта роста осадка
- •8 Морфология осадков, получаемых при ограничении массопереноса
- •8.1 Электролиз на предельном токе диффузии.
- •8.2 Образование сферолитов
- •8.3 Микрораспределение тока и металла при пассивировании поверхности катода
- •Литература
3.4. Cовместный разряд ионов целевого металла и примесей
В этом случае на катоде совместно восстанавливаются ионы целевого металла и примесных элементов по схеме, изложенной в разделе 3.1. Рассмотрим его на примере 2-х реакций:
-
1) Mecn+ + nме ®Mec Jм
-
2) Kni+ + nie ®Mei Ji
где K – примесь, Mec – целевой металл.
Основной задачей теории является выявление связи между содержанием примеси в металле и параметрами электролиза.
Обозначив через А массовую долю примеси в катодном металле, и используя закон Фарадея, можно записать:
A
![]() (3.11)
(3.11)
где qi и qм – электрохимические эквиваленты примеси и целевого металла.
Выражение (3.11) не отличается от выражения 3.6 (п 3.1), определяющего распределение тока между реакциями. Следовательно, и в этом случае, можно воспользоваться результатами анализа распределения тока между двумя реакциями, изложенными в п. 3.1. Отличие состоит лишь в том, что концентрации примесных ионов в растворе на несколько порядков ниже концентрации ионов целевого металла и поэтому Jм Ji. Поэтому можно принять, что суммарная плотность тока равна плотности тока восстановления ионов целевого металла:
Jм J . (3.12)
С учетом этого допущения получается следующая зависимость содержания примеси от суммарной плотности тока:
A
![]() (3.13)
(3.13)
Плотности тока примеси и металла являются функциями концентрации ионов, температуры и потенциала (суммарной плотности тока), поэтому и А является функцией от этих же параметров. Поэтому, если известны уравнения парциальных кривых то, подстановкой их в выражение (3.13), можно получить количественные зависимость содержания примесей в металле от перечисленных параметров электролиза.
Отметим, что из-за низкой концентрации скорость восстановления ионов примесей в большинстве случаев контролируется диффузией или диффузией совместно с реакцией. Кинетический контроль наблюдается для компонентов, имеющих близкие величины равновесных потенциалов, а также при соосаждении примесей с металлами, имеющими высокие плотности тока обмена.
В отличие от восстановления примесных ионов, восстановление ионов целевого металла по целому ряду причин ведется в режимах, в максимальной степени предотвращающих диффузионные ограничения.
Поляризационные кривые при диффузионном контроле существенно разнятся от кривых при кинетическом контроле наличием точек перегиба и площадок предельного тока. По этому, как уже указывалось в разделе 3.2, различаются зависимости А- J и Вт- J.
Рассмотрим наиболее часто встречающиеся на практике случаи.
Cлучай 1. Ионы металла и примесей восстанавливаются с контролем скорости стадией разряда- ионизации.
Уравнения парциальных кривых полностью аналогичны таковым для совместного разряда металла и водорода:
ионы
примесей -

ионы
металла -

После подстановки уравнений кривых и замены активностей концентрациями получим уравнение зависимости содержания примеси и от потенциала
![]() ,
,
из которого следует, что содержание примеси может по - разному зависeть от потенциала.
1. Не зависеть при bi=bm; 2. Возрастать при bibm;
3. Уменьшаться при bi< bm;
Так как и в этом случае для практики нужна зависимость содержания примеси не от потенциала, а от плотности тока, то ее можно получить следующим путем. Из уравнений для парциальных кривых можно получить обратные функции Еi =Fi (ci,T,Ji) и Eм = Fm(cм, T, Jм). В рассматриваемом случае это уравнения Тафеля, отличающиеся величинами коэффициентов «аТ» и «вТ».
Учитывая, что при совместном разряде Ем = Еi , то, приравняв обратные функции, получим уравнение зависимости плотности тока примеси от плотности тока целевого металла. Подставляя его в выражение (3.13), получим искомую зависимость содержания примеси в металле как функцию концентрации ионов примеси и металла в растворе, плотности тока и констант скоростей восстановления ионов примесей и металла. Опуская алгебраические преобразования, приведем их конечный результат:
![]() (3.14)
(3.14)
Входящие в это уравнение постоянные равны:
![]() и
и

Коэффициент l=aini/aмnм= (b)м/(b)i , то есть может быть определен по угловым коэффициентам парциальных поляризационных кривых, проведенных в координатах уравнения Тафеля.
Уравнение (3.14) получено создателями теории совместного разряда металла и примесей В.Л. Хейфецом и А.Л. Ротиняном в середине прошлого столетия и подтверждено на многочисленных примерах совместного разряда различных металлов. Из него следуют следующие выводы:
1). В зависимости от величины коэффициента содержание примесей в металле может не зависеть от плотности тока (=1), возрастать с ее ростом (1) или уменьшаться (< 1).
2). Содержание примеси в металле пропорционально ее концентрации в растворе, коэффициент пропорциональности включает отношение констант скоростей реакции восстановления ионов, которое для разных сортов ионов может сильно различаться. По этой причине разные примеси будут включаться в катодный металл в разной степени при одинаковой концентрации в растворе.
3). Содержание примеси в металле уменьшается с увеличением концентрации ионов металла в растворе.
4). Как и в случае совместного разряда ионов металла и водорода, температура влияет на включение примесей через температурные зависимости констант скоростей реакций восстановления ионов металла и примеси. Если увеличение температуры увеличивает константу скорости восстановления примесей в большей степени, чем металла, то с ее увеличением осадок будет в большей степени загрязняться примесями и на оборот.
В качестве примеров, иллюстрирующих эти выводы, приведем некоторые экспериментальные данные[3] .
Рис. 3.9 иллюстрирует влияние природы примесей, a рис. 3.10- разный вид зависимостей от плотности тока.
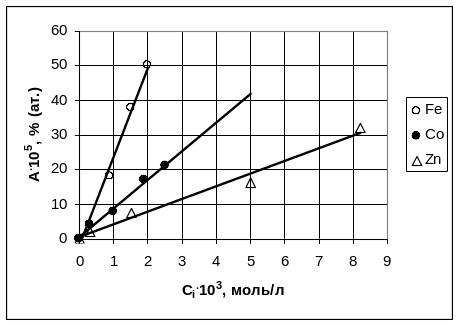
Рис.3.9. Включение примесей в катодное олово.
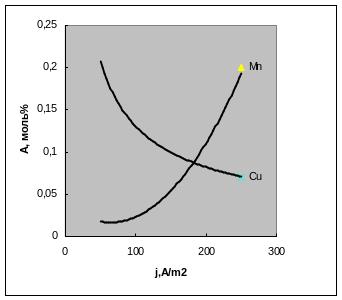
Рис.3.10. Включение меди и марганца в катодный осадок никеля
Случай 2. Ионы примесей восстанавливаются на предельном токе диффузии.
В этом случае уравнение для плотности тока восстановления ионов примесей записывается в виде:
 ,
(3.15)
,
(3.15)
где D – коэффициент молекулярной диффузии ионов примеси; - толщина диффузионного слоя. То есть, плотность тока восстановления примесей не зависит от потенциала и поэтому не зависит от плотности тока восстановления металла. Тогда, подставив уравнение (3.15) в выражение (3.12) и, объединив все постоянные в константу В, получим приближенное решение (рис. 3.11, кривая 1):
A= 1/(1 +Jм/Ji) 1/(1 +J/Ji) = BCi/J (3.16)
Точное решение уравнения (3.16) отличается тем, что в некотором диапазоне плотностей тока до начала совместного разряда, когда на катоде восстанавливается одна примесь, А = 1. По достижении начала совместного разряда А будет уменьшаться в соответствии с кривой Вт-1 рисунка 1(п. 1.1). На рисунке 3.11 приведены приближенное и точное решения, которые довольно быстро сходятся.
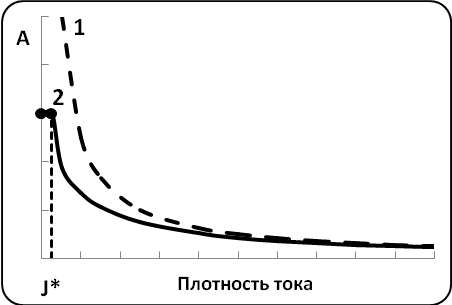
Рис. 3.11. Зависимость содержания примесей от плотности тока
Из уравнения (3.16) следует, что содержание примеси в катодном металле обратно пропорционально плотности тока и прямо пропорционально концентрации примеси в электролите. Так как коэффициенты диффузии различных ионов в растворах близки, то угловой коэффициент зависимости А от c одинаков для различных примесей. Рисунок 3.12 полученный на примере включения примесей в катодный никель, иллюстрирует это заключение.

Рис. 3.12. Зависимость содержания примесей в катодном никеле от их концентрации в электролите
Случай 3. Ионы примеси восстанавливаются с концентрационной поляризацией, ионы металла - с контролем скорости стадией разряда- ионизации.
Используя аналогичный способ анализа, нетрудно показать, что в этом случае содержание примесей в металле следующим образом зависит от плотности тока:
![]() (3.17)
(3.17)
где k1 = ni /мnм и j * - плотность тока металла при равновесном потенциале примеси. Отличие этого случая состоит в том, что зависимость содержание примеси от плотности тока описывается кривой с максимумом. Вначале содержание примеси растет, достигает максимума и далее уменьшается (рисунок 3.13).
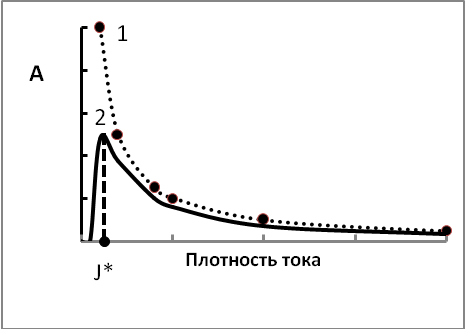
Рис. 3.13. Зависимость содержания примеси от плотности тока
Необходимо отметить, что зависимость содержания примеси от плотности тока в этом случае аналогична зависимости Вт2 от плотности тока, полученной ранее (рис.3.5 п. 3.2).
