
- •Электролиз в гидрометаллургии. Теоретические основы
- •Оглавление
- •Введение
- •1. Структура и свойства электролитических осадков гидрометаллургии
- •1.1 Требования к качеству металла
- •1.2. Связь структуры осадка с его качеством
- •1 Структура электролитических осадков
- •2Включение в катодный осадок неметаллических примесей.
- •1.3 Требования к параметрам электролиза
- •3. Особенности электродных процессов гидрометаллургии
- •3.1Равновесные потенциалы металлов и диаграмма устойчивости воды.
- •2.2 Равновесные потенциалы мультивалентных металлов
- •2.3 Бестоковые потенциалы металлов
- •2.4 Катодный процесс
- •3. Параллельные катодные реакции
- •3.1 Общие положения теории совместного разряда. Необходимые и достаточные условия
- •3.2. Распределение тока между реакциями
- •3.3. Совместный разряд ионов металла и водорода
- •3.4. Cовместный разряд ионов целевого металла и примесей
- •4Основные положения теории электрокристаллизации металлов
- •4.1Образование зародышей и центров кристаллизации
- •4.2 Кинетика зародышеобразования
- •4.3 Скорость роста зародышей.
- •4.4Физические модели формирования катодных осадков
- •5 Формирование двумерных (2d) структур
- •6 Формирование трехмерных (3d) структур
- •6.1 Динамика формирования катодного осадка
- •6.2Влияние параметров электролиза на микроструктуру осадка
- •7Микрораспределение тока и металла по поверхности катода
- •7.1 Критерии устойчивости роста
- •7.2Влияние режимов электролиза на устойчивость фронта роста осадка
- •8 Морфология осадков, получаемых при ограничении массопереноса
- •8.1 Электролиз на предельном токе диффузии.
- •8.2 Образование сферолитов
- •8.3 Микрораспределение тока и металла при пассивировании поверхности катода
- •Литература
3.3. Совместный разряд ионов металла и водорода
Этот случай совместного разряда относится к ситуации, когда на катоде протекают две реакции:
1) восстановление ионов металла Меn+ + ne = Me jM (J1)
2) восстановление ионов водорода 2Н+ + 2е = Н2 jH (J2)
Целевой является первая реакция, которую необходимо осуществлять с максимальным выходом потоку.
Рассмотрим условия совместного разряда для двух случаев, различающихся равновесными потенциалами реакции восстановления ионов металла.
Первый – совместный разряд ионов металла и водорода при электролизе электроположительных металлов, например меди. Разность стандартных равновесных потенциалов Е = +0,34 – 0,0 = 0,34В. Следовательно, совместный разряд будет происходить при перенапряжении меди 1 0,34В.
Второй - совместный разряд ионов электроотрицательного металла, например цинка (Е1= -0,76В), и водорода из сернокислых растворов аналогичного состава. В этом случае разность равновесных потенциалов Е= 0,76В и совместный разряд будет происходить при перенапряжениях реакции восстановления ионов водорода 2 0,76В, т.е. при катодных потенциалах менее – 0,76В. Для дальнейшего анализа необходима информация о парциальных кривых реакций.
Кинетика восстановления ионов водорода была предметом обширных теоретических и экспериментальных работ, Для наших целей важны их следующие результаты:
При восстановлении водорода на металлах соблюдается Тафелевская зависимость перенапряжения от плотности тока, коэффициент “b” не зависит от металла, на котором идет реакция и равен 0,116 В.
Величина коэффициента “a” уравнения Тафеля зависит от природы металла, поэтому перенапряжение водорода на металлах может существенно различаться (таблица 1).
Скорость реакции на большинстве металлов контролирует стадия разряда- ионизации.
Таблица 3.1. Перенапряжение выделения водорода (н) при плотности тока 600 А/м2 из 2н. раствора H2SO4 при 250C
Meталл |
Pb |
Zn |
Sb |
Cd |
Cu |
Ge |
Fe |
Co |
Ni |
Re |
н, B |
1,2 |
1,1 |
0,79 |
0,84 |
0,68 |
0,76 |
0,55 |
0,48 |
0,44 |
0,23 |
Поэтому парциальная поляризационная кривые водорода описывается следующими выражениями:
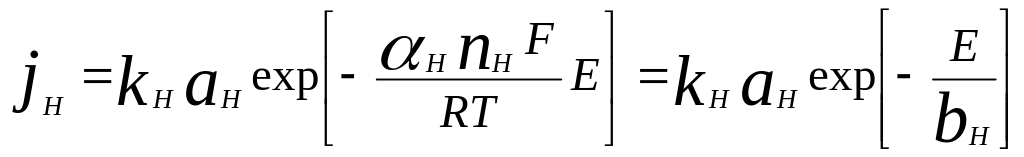 ,
,
где bH= 2RT/F =0,116 B, величина пред экспоненциального коэффициента для каждого металла может быть получена по данным табл. 3.1.
Парциальные кривые восстановления ионов металлов из простых электролитов, применяемых в гидрометаллургии, при кинетическом контроле скорости описываются аналогичным уравнением:

в котором коэффициент bM = (0,06 -0,08)B
Рассмотрим для обоих случаев влияние параметров электролиза на выход по току металла.
Плотность тока.
Первый случай. Особенность этого случая состоит в том, что такие промышленно получаемые металлы, такие как Cu, Ag, Pd имеют высокие равновесные потенциалы и плотности тока обмена. По этим причинам их совместный разряд с водородом из кислых растворов может происходить только при условии восстановления ионов металлов на предельном токе диффузии. То есть уравнение парциальной кривой металла имеет вид: Jм = J*= const (плотность тока не зависит от потенциала).
Поэтому зависимость выхода по току от плотности тока, получаемая при подстановке парциальных плотностей тока в уравнение (3.6), записывается виде :
Вт1
= ![]() =
=![]() (3.10)
(3.10)
В этом случае выход по току должен уменьшаться от 1 до 0 при повышении плотности тока свыше J*. Аналогичный результат получается при использовании методики, изложенной в разделе 1.2. Формально независимость плотности тока металла от потенциала означает, что коэффициент m в уравнении (3.7) равен 0 , а k > m, то есть зависимость выход по току металла от перенапряжения описывает кривая Вт1 рис. 3.2 и аналогичным образом зависит выход по току от плотности тока.
Второй случай. Зависимость выхода по току от плотности тока в этом случае можно получить с использованием методики раздела 1.2 (Вариант 1, выход по току Вт2). В этом случае необходимо, чтобы соблюдалось условие k > m, то есть bH bМ. Для катионов металлов, имеющих nM=2 и aм=aн =0,5 теоретическая величина коэффициента bM = 0,059 В(при температуре 250С), что в 2 раза меньше величины bH =0,116В. Экспериментально полученные величины bМ несколько выше теоретических (от 0,06 до 0,08В), но меньше bH . По этому выход по току металла должен возрастать с увеличением перенапряжения (кривая Вт2 рис. 3.2). Так как вид зависимости выхода по току от плотности тока идентичен зависимости от перенапряжения, то выход по току возрастает с ростом плотности тока. При равенстве величин bH = bм, выход по току металла не зависит от перенапряжения. На рисунке 3.6 представлены зависимости выхода по току металла от плотности тока. Отметим, что J*и J** обозначены плотности тока начала совместного разряда.

Рисунок 3.6.
Природа металла.
Из таблицы 3.1 видно, что перенапряжение водорода (или скорость его восстановления) на разных металлах существенно различается. Поэтому отношение JH/JM металлов железной группы, рений или марганец выше, чем для свинца и цинка и выход по току этих металлов существенно различается.
Поясним сказанное следующим примером. Сопоставим выход по току металла при совместном разряде ионов никеля и водорода из раствора, содержащего 1н NiSO4 + 1н H2SO4 и ионов цинка и водорода из раствора с такой же концентрацией сульфата цинка и серной кислоты, температура 250 С.
Уравнения парциальных поляризационных кривых восстановления ионов, полученные при исследовании кинетики восстановления ионов никеля А.Л. Ротиняном и цинка Ю.В. Баймаковым и А.И. Журиным имеют следующий вид (плотность тока в А/м2):
раствор сульфата никеля ЕNi = 0,35 + 0,085lgiNi , Ен =0.38 + 0.15lgiH
раствор сульфата цинка ЕZn = 0,79 + 0, 041lg jZn, Ен = 0.816 + 0, 118 lg jн
С использованием этих уравнений рассчитаны зависимости выхода по току металл от плотности тока (рисунок 3.7). Из рисунка видна разница между металлами. Выход по току никеля примерно в 3 раза ниже, и может достигнуть приемлемого для практики уровня 0,8-0,9 при не реально высоких для практического применения плотностях тока.
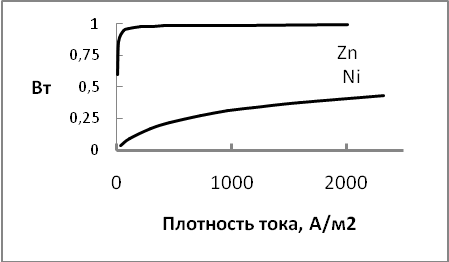
Рис. 3.7. Зависимость выхода по току металла от плотности тока в системах Ni-H и Zn- H
Состав электролита.
Из выражения (3.5) следует, что увеличение концентрации ионов металла и снижении концентрации ионов водорода увеличивает выход по току металла и наоборот. Этим способом достигается совместный разряд при электролизе электроотрицательных металлов, имеющих низкое перенапряжение выделения водорода. В частности, выход по току никеля должен увеличиваться с уменьшением концентрации кислоты. На рисунке 3.8 приведены расчетные кривые зависимости Вт от плотности тока для растворов с концентрацией кислоты рН=0 и рН=2,5, которые подтверждают это заключение.
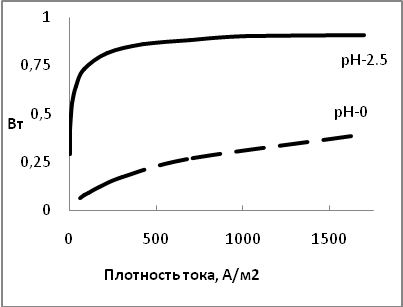
Рис.3.8 Влияние концентрации кислоты в электролите на выход по току никеля.
Температура электролита
В выражении (3.5) от температуры зависят величины констант скоростей обеих реакций (kH и kM) и величины коэффициентов bH и bM. Увеличение температуры электролита повышает константу скорости каждой реакции. Поэтому, если kH, увеличивается с ростом температуры в большей степени, чем kM, то выход по току металла будет уменьшаться и наоборот.
