
- •Біофізика складних систем
- •Передача інформації в сенсорних системах організму
- •13.1. Основні поняття теорії інформації
- •13.2. Трансформація подразнень у рецепторах
- •13.3. Передача та переробка інформації в нервових центрах
- •13.4. Характеристики суб‘єктивних сенсорних відчуттів
- •Керування руховою функцією організму
- •14.1. Скелетні м‘язи як системи саморегуляції
- •14.2. Скелетні м‘язи як ефектори.
- •Сталість внутрішнього середовища організму та його регуляція
- •15.1. Характеристики внутрішнього середовища організму
- •15.2. Регуляція кровообігу
- •15.3. Регуляція газового складу крові
- •15.4. Регуляція концентрації енергетичних речовин у крові
- •15.5. Регуляція температури крові
- •15.6. Регуляція осмотичного тиску крові
- •Контрольні запитання до частини IV
15.3. Регуляція газового складу крові
Як уже зазначалося, найважливішою функцією крові є постачання тканин киcнем і виведення з них вуглекислого газу. Потреба тканин у кисні значно змінюється в ході їхньої життєдіяльності, так само як і об’єм СО2, що утворюється в результаті обміну. Тому підтримання сталості парціального тиску обох газів є одним з основних компонентів гомеостатичної функції кровообігу. Оскільки надходження кисню у кров і виведення з неї СО2 відбуваються через кінцеві розгалуження повітроносних шляхів легень – альвеоли, то провідним компонентом у підтриманні такої сталості є забезпечення постійного складу повітря в альвеолах.
Альвеоли вентилюються притоком і відтоком повітря при ритмічному розширенні й стисканні легень у результаті збільшення й зменшення об‘єму грудної клітини за рахунок скорочення діафрагми й міжреберних м‘язів. На відміну від ритмічної діяльності серця, яка заснована на внутрішній здатності до автоматії й лише регулюється реципрокними впливами симпатичних і парасимпатичних еферентних волокон, ритм дихання має центральне походження й породжується відповідними командами зі спеціальної системи нейронів довгастого мозку (дихального центру). Ці команди передаються по соматичних еферентних шляхах, аналогічних шляхам активації інших типів скелетних м‘язів.
Частота дихання та глибина кожного подиху (дихальний об‘єм) залежать від активності цього центру, яка, таким чином, і визначає склад альвеолярного повітря й відповідно парціальний тиск О2 та СО2 в артеріальній крові. При цьому діапазон його регулювання є величезним: під час максимального фізичного навантаження поверхня альвеол може забезпечувати перенесення кисню зі швидкістю до 5000 мл/хв, а у стані спокою – лише близько 250 мл/хв.
При регуляції артеріального тиску керівний сигнал формується у спеціальних барорецепторних структурах артеріального русла. Щодо регуляції дихання, то ситуація є більш складною, оскільки в цьому випадку мова може йти вже про двох кандидатів на роль регульованої змінної – рО2 та рСО2 у крові, реєстрація змін яких може відбуватися різними рецепторними структурами як на периферії, так і в центральній нервовій системі. Крім того, роль кожної із цих змінних може суттєво варіювати залежно від умов функціонування організму.
У стані спокою та нормального атмосферного тиску з двох зазначених змінних основну роль відіграє, як свідчать результати експериментів, саме друга – парціальний тиск у крові СО2. Це добре видно з наведеної на рис. 15.5 схеми, на якій представлено зміни дихання (його хвилинного об‘єму) при зниженні у повітрі, що вдихається, концентрації О2 або підвищенні концентрації СО2. Отже, хвилинний об‘єм дихання не змінюється практично доти, доки вміст О2 не скоротиться до половини його нормального рівня. Таким чином, сама по собі гіпоксія (зниження рО2 в артеріальній крові) виявляється в цих умовах дуже малоефективним стимулом для поглиблення дихання. Навпаки, підвищення рСО2 у повітрі, яке вдихується (гіперкапнія), стимулює дихання відразу, як тільки воно перевищує нормальний рівень.

Рис. 15.5. Зміни вентиляції легень у людини при зниженні концентрації кисню або підвищенні концентрації вуглекислого газу у повітрі що вдихається. По осі ординат – хвилинний об’єм дихання, по осі абсцис – парціальний тиск газу, що вдихається. Заштрихована смуга вказує максимальний об’єм легеневої вентиляції, на яку був здатний досліджуваний
На перший погляд, така ситуація може здатися парадоксальною, оскільки саме недостатність кисню є тим основним фактором, який може швидко привести до порушення життєвих процесів. Сам по собі надлишок СО2 до таких порушень не має приводити. Але річ у тім, що у природних умовах існування організму обидва параметри не є незалежними і їхні зміни завжди тісно пов‘язані – недостатня вентиляція легень приводить як до накопичення у крові вуглекислоти, так і до недостачі кисню. Імовірно, що з погляду можливих біофізичних механізмів використання як сигналу змін рівня вуглекислоти є більш надійним, ніж змін рівня кисню, і саме цей механізм у ході еволюційного процесу закріпився як основне джерело інформації в системі регуляції дихання.
При підйомі на значну висоту ситуація істотно змінюється. Такий підйом супроводжується наростаючою гіпоксією й водночас гіпокапнією (зниженням рівню СО2 у крові) за рахунок зниження загального барометричного тиску. У цьому випадку якраз стимулююча дія гіпоксії на дихання набуває провідного значення, і підтримання рівню кисню у повітрі, що вдихується, відіграє основну роль у підтриманні газового складу крові.
Що ж являють собою відповідні датчики? Найбільше значення мають рецептори, що розташовані безпосередньо над вентральною поверхнею довгастого мозку й реагують на зміни рСО2 спинномозкової рідини (яка в свою чергу точно відображає зміни рСО2 в артеріальній крові). Ці рецептори може бути віднесено до хеморецепторів; при цьому зміни рСО2 та рН артеріальної крові справляють на них неоднаковий вплив (перші є більш ефективними). Це ще не означає, що на поверхні є два різні типи хеморецепторних структур, чутливих або до СО2, або до Н+. Можливо, що ці хеморецептори є власне рецепторами протонів, а дія СО2 пов‘язана з утворенням останніх у ході дисоціації вуглекислоти. У такому разі різниця в ефектах змін рСО2 та рН може бути пов‘язана з різною швидкістю їх транспорту у тканинах. Відомо, що СО2 дуже швидко дифундує з крові через клітинні мембрани, тоді як для перенесення іонів Н+ необхідні особливі мембранні структури – іонні канали або переносники.
Рецептори змін газового складу крові містяться також безпосередньо у стінці судин, у тому числі у вже згаданому каротидному синусі. Ці хеморецептори реагують саме на зниження парціального тиску О2 і меншою мірою – на підвищення рСО2 або зниження рН. Тому реакція дихання на підвищення рСО2 чи зниження рН майже цілком залежить від активації рецепторів самого мозку, тоді як більш слабка реакція на зниження рО2 – від периферійних хеморецепторів.
Комплекс нейронів, що ідентифікується як дихальний центр, у своїй функціональній організації має багато спільного з розглянутим вище судиноруховим центром – він також складається з двох пов‘язаних між собою нейронних сіток, одна з яких включається в активність під час вдиху, а друга – видиху. Ці нейронні системи за допомогою низхідних шляхів з‘єднані з руховими нейронами дихальних м‘язів, і виникаючі в них командні сигнали викликають періодичні скорочення останніх. Дві системи нейронів у довгастому мозку перебувають між собою у реципрокних взаємовідношеннях: одна з них у стані збудження, друга – гальмування. Далі активність першої зменшується й гальмування реципрокної системи слабшає, що і створює можливості для переходу другої в активний стан і зворотного гальмування першої.
Ця здатність до ритмічного переключення активності з одної нейронної системи на іншу зберігається навіть в ізольованому довгастому мозку; але для її стабілізації та приведення у відповідність до газового складу крові необхідне постійне надходження до неї інформації від описаних вище центральних і периферійних хеморецепторів, що веде або до збільшення частоти та поглиблення дихальних скорочень і відповідно до збільшення хвилинного об‘єму дихання, або, навпаки, до їх зменшення та послаблення й до зниження останнього.
Крім описаних системи зворотних зв‘язків, що функціонують на основі сигналів про зміни в хімічному складі крові, важливу роль у регуляції дихання відіграють також зворотні зв‘язки, що використовують сигнали від механорецепторів, розташованих безпосередньо в легенях. Якщо легені занадто роздуваються підчас вдиху, останній рефлекторно гальмується й починається видих. Навпаки, якщо істотно зменшити об‘єм легень підчас видиху, то це стимулює виникнення глибокого вдиху (так звані рефлекси Герінга–Брейера). Основою виникнення зазначених рефлекторних актів є подразнення механорецепторів, розташованих безпосередньо в легеневій тканині, а також у трахеї, бронхах і бронхіолах. Деякі із цих рецепторів є позиційними та відповідно реагують ритмічною імпульсацією на ступінь розтягнення легеневої тканини, інші швидше диференційними, що збуджуються при зменшенні або збільшенні такого розтягнення. Завдяки цьому нервова система одержує постійну інформацію як про ступінь розтягнення легень, так і про зміни цього розтягнення. Аферентні сигнали від відповідних рецепторів надходять до спинного мозку й по висхідних шляхах справляють вплив на активність нейронних структур дихального центру. При перерізі таких шляхів дихання робиться рідким і глибоким; відповідно у фізіологічних умовах їхні впливи обмежують дихальні екскурсії й роблять роботу дихальної системи економічнішою.
На схемі (рис. 15.6) показано головні системи зворотних зв‘язків, що відповідають за підтримання газового гомеостазу крові.
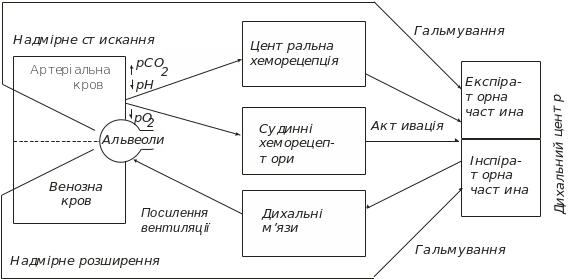
Рис. 15.6. Загальна схема прямих і зворотних зв’язків, що беруть участь у регуляції дихання
