
- •Тема I. Основные понятия и законы химической кинетики Задание 1
- •Задание 2
- •Задание 3
- •Задание 4
- •Задание 5
- •Задание 6
- •Задание 7
- •Какие экспериментальные данные необходимы для определения порядка реакции?
- •Задание 8
- •Задание 9
- •Задание 10
- •Задание 11
- •Задание 12
- •Задание 13
- •Задание 14
- •Задание 15
- •Задание 16
- •2. Какие экспериментальные данные необходимы для определения порядка реакции?
Задание 9
В каких случаях скорость реакции определяется изменением концентрации реагирующих веществ в единицу времени?
Могут ли молекулярность и порядок реакции быть дробными величинами?
Как доказать, что реакция имеет первый порядок?
Какую информацию о химической реакции можно получить из зависимости концентрации реагирующего вещества от времени?
Экспериментально установленное уравнение для скорости реакции 2NO + O2 2NO2 имеет вид:
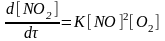 .
Можно ли сделать вывод, что:
.
Можно ли сделать вывод, что:
а) реакция является трехмолекулярной;
б) реакция протекает в одну стадию;
в) реакция имеет в целом третий порядок;
г) реакция имеет первый порядок по NO и O2?
В реакции ClO¯ + Br¯ BrO¯ + Cl¯ концентрация BrO¯. в различные промежутки времени составила:
-
, с
0
3,65
7,65
26,00
47,60
BrO¯.102, моль/л
0
0,0560
0,0953
0,1800
0,2120
Концентрация NaClO и KBr в реакционной смеси при 0 равны соответственно 0,00323 и 0,002508 моль/л. Каков порядок реакции и чему равна константа скорости?
Задание 10
Что означает запись
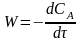 для реакции А
В? Может ли скорость быть отрицательной
величиной?
для реакции А
В? Может ли скорость быть отрицательной
величиной?Как зависит от исходной концентрации реагирующих веществ период полупревращения для реакции первого порядка?
Какие способы определения порядка реакции относятся к группе дифференциальных методов?
Если определяют порядок реакции А + В С при условии СА = СВ, то какой порядок реакции - частный или общий - получают при таком подходе?
Для газофазных реакций типа А В + С + Д получите выражение для константы скорости, используя величины исходного (Ро) и общего (Р) давления газа в системе.
Константа скорости реакции второго порядка
СН3СООС2Н5 + NaOH CH3COONa + C2H5OH
равна 5,4 л/моль.с. Начальные концентрации эфира и щелочи равны соответственно 0,04 и 0,02 моль/л. Сколько эфира прореагирует через 10 мин от начала реакции?
Задание 11
Запишите выражение для константы скорости реакции второго порядка при неравных концентрациях исходных веществ.
Как экспериментально определить скорость химической реакции?
Если при определении порядка реакции используют метод избытка (изолирования) Оствальда, то какой порядок реакции - общий или частный - определяют при таком подходе?
В каких координатах нужно построить график, чтобы получить линейную зависимость функции концентрации от времени для реакции первого порядка?
Для реакции J¯+OСl¯Cl¯+OJ¯ экспериментально установлено следующее кинетическое уравнение: W = К[J¯][OСl¯]. Каков полный порядок реакции? Объясните ответ. Сделайте предположение о механизме этой реакции.
В реакции изомеризации дихлорэтана
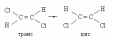
концентрация трансизомера. в различные промежутки времени составила:
-
, мин
0
10
20
30
Концентрация
транс-изомера, моль/л
1,0
0,9
0,81
0,73
Каков порядок реакции? Сколько времени необходимо для изомеризации половины количества транс-изомера?
