
- •Тема I. Основные понятия и законы химической кинетики Задание 1
- •Задание 2
- •Задание 3
- •Задание 4
- •Задание 5
- •Задание 6
- •Задание 7
- •Какие экспериментальные данные необходимы для определения порядка реакции?
- •Задание 8
- •Задание 9
- •Задание 10
- •Задание 11
- •Задание 12
- •Задание 13
- •Задание 14
- •Задание 15
- •Задание 16
- •2. Какие экспериментальные данные необходимы для определения порядка реакции?
Тема I. Основные понятия и законы химической кинетики Задание 1
Что понимают под термином «скорость химической реакции»? От каких факторов она зависит?
Укажите размерность константы скорости для реакции нулевого порядка.
Какие экспериментальные данные необходимы для определения порядка реакции?
Выведите уравнение для периода полупревращения (1/2) исходных веществ для реакции второго порядка, если начальные концентрации реагирующих веществ одинаковы.
Для газофазных реакций типа А В + С получите выражение для константы скорости (К), используя величины исходного (Ро) и общего (Р) давления газа в системе.
При разложении N2O5 в CCl4 объем кислорода (V), выделяющегося через различные промежутки времени составил:
-
, мин
10
20
30
40
V, см3
6,3
11,4
15,53
18,9
34,75
Рассчитайте константу скорости и покажите графически, что это реакция первого порядка.
Задание 2
Сформулируйте основной постулат химической кинетики.
Запишите математическое выражение истинной скорости реакции АВ.
Какие способы определения порядка реакции относятся к группе интегральных методов?
Изобразите графически зависимость константы скорости реакции от концентрации исходных веществ.
Как объяснить, что реакция
30C2H5OH + B10H14 10B(OC2H5)3 + 22H2
имеет не 31-й, а 2-й порядок? Запишите кинетическое уравнение скорости для данного примера.
При каталитическом распаде аммиака на простые вещества (на вольфрамовой нити при Т=11000 С) время, необходимое для разложения половины всего количества NH3, зависит от начального давления аммиака следующим образом:
-
Р, мм.рт.ст.
265
130
58
1/2, мин
7,6
3,7
1,7
Определите порядок реакции и константу скорости.
Задание 3
Поясните физический смысл константы скорости. От каких параметров она зависит?
Может ли порядок реакции быть дробным?
Графическим выражением какой зависимости является кинетическая кривая?
При изучении кинетики реакции получен ряд значений изменения концентрации исходного вещества по времени. Какой метод определения порядка реакции наиболее эффективен в этом случае?
Какая из необратимых реакций заканчивается быстрее при одинаковых исходных концентрациях и одинаковых константах скорости: реакция 1-го, 2-го или 3-го порядка?
Д
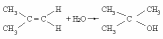 ля
реакции
ля
реакции
константа скорости К = 2,2.10—4 с—1. Определите исходую концентрацию изобутилена, если через 3600 с после начала реакции концентрация его стала 1,0.10—4 моль/л.
Задание 4
Что называется порядком химической реакции? Для каких реакций порядок и молекулярность всегда совпадают?
Какие методы могут использоваться при определении скорости реакции?
Укажите размерность константы скорости для реакции 1-го порядка.
Изобразите схематически на одном графике кинетические кривые для исходного вещества в случае необратимых реакций первого и второго порядков.
Сопоставьте константы скоростей двух реакций первого порядка, если период полупревращения первой реакции в пять раз больше, чем второй.
При протекании химической реакции
Cu + (NH4)S2O8 = CuSO4 + (NH4)2SO4.
концентрация CuSO4 в различные промежутки времени составила:
-
, мин
5
10
25
Концентрация CuSO4, моль/л
0,01
0,02
0,048
Исходная концентрация (NH4)S2O8 равна 0,219 моль/л. Определите порядок реакции и константу скорости.
