- •Н.Ф. Стась введение в химию
- •Томск 2007
- •Л.Д. Свинцова
- •А.В. Коршунов
- •Можно ли изменить эту ситуацию? Какими методическими приёмами можно сократить время изучения «начал» химии?
- •2. Этапы развития химии
- •1. Стехиометрические законы
- •2. Химические элементы
- •3. Простые вещества и соединения
- •4. Валентность
- •5. Формулы соединений
- •6. Структурные формулы
- •7. Атомные и молекулярные массы
- •8. Количество и молярная масса вещества
- •9. Молярный объем газа
- •10. Закон эквивалентов
- •101325 Па соответствует 760 мм рт. Ст.
- •11. Химические реакции
- •12. Стехиометрические расчеты
- •12.1. Расчеты по формулам веществ
- •12.2. Расчеты по уравнениям реакций
- •12.3. Расчеты по закону эквивалентов
- •13. Способы определения атомной массы
- •14. Определение молекулярных масс соединений
- •15. Установление формул соединений
- •Тест для самоконтроля
- •1) MnSo4 2) Mn2o7 3) MnO2 4) k2MnO4
- •Задачи и упражнения для самостоятельного решения
- •Глава 2. Классификация и номенклатура неорганических веществ
- •1. Оксиды
- •1.1. Классификация оксидов
- •1.2. Номенклатура оксидов
- •1.3. Свойства оксидов
- •1.4. Получение оксидов
- •1.5. Закономерности изменения свойств оксидов
- •1.6. Двойные оксиды
- •1.7. Пероксиды
- •2. Основания
- •2.1 Классификация оснований
- •2.2. Номенклатура оснований
- •2.3. Свойства оснований
- •2.4. Получение оснований
- •3. Кислоты
- •3.1. Классификация кислот
- •3.2. Номенклатура кислот
- •3.3. Свойства кислот
- •3.3.1. Взаимодействие кислот с металлами
- •3.4. Получение кислот
- •4. Соли
- •4.1. Состав и классификация солей
- •4.2. Номенклатура солей
- •4.3. Свойства солей
- •4.4. Получение солей
- •5. Взаимосвязь между классами веществ
- •6. Современный подход к классификации оснований и кислот
- •7. Тривиальные названия неорганических соединений
- •8. Тест для самоконтроля
- •9. Упражнения для самостоятельной работы
- •Глава 3. Периодическая система химических элементов д.И. Менделеева
- •1. Основные формы Периодической системы
- •2. Периодические свойства элементов
- •2.1. Атомные и ионные радиусы химических элементов
- •2.2. Энергия и потенциал ионизации атомов
- •2.3. Сродство к электрону
- •2.4. Электроотрицательность
- •2.5. Валентность
- •3. Периодические свойства соединений
- •4. Тест для самоконтроля
- •1) Магний 2) Марганец 3) Молибден 4) Менделевий 5) Мейтнерий
- •5. Задачи и упражнения для самостоятельной работы
- •Глава 4. Химические реакции
- •3.1. Степень окисления и валентность
- •3.2. Окислительно-восстановительные реакции
- •3.3. Окислители и восстановители
- •3.4. Классификация окислительно-восстановительных реакций
- •3.5. Метод электронного баланса
- •3.6. Метод полуреакций
- •3.7. Реакции с участием пероксидов
- •3.8. Эквиваленты окислителей и восстановителей
- •3.9. Тест для самоконтроля
- •1) Восстановителя 2) Окислителя 3) Восстановителя и окислителя 4) Среды
- •3.10. Упражнения для самостоятельной работы
- •Глава 5. Растворы
- •1. Концентрация растворов
- •2. Стехиометрические расчёты по уравнениям реакций в растворах
- •3. Растворимость веществ
- •4. Электролитическая диссоциация
- •5. Степень электролитической диссоциации
- •6. Ионная теория кислот и оснований
- •7. Ионообменные реакции
- •8. Гидролиз солей
- •9. Тест для самоконтроля
- •10. Задачи и упражнения для самостоятельной работы
- •Ответы к тесту для самоконтроля
- •Ответы к упражнениям
4.3. Свойства солей
Соли – твёрдые кристаллические вещества с ионными химическими связями между катионами и анионами. Химические свойства солей обусловлены их взаимодействием с металлами, кислотами, щелочами и солями.
Соли взаимодействуют с металлами: более активный металл вытесняет менее активные из растворов их солей:
Mg + FeCl2 = MgCl2 + Fe¯; Ni + CuSO4 = NiSO4 + Cu¯
Соли взаимодействуют с кислотами:
AgNO3 + HCl = AgCl¯ + HNO3; Na2S + 2HCl = NaCl + H2S↑
Соли взаимодействуют со щелочами:
CuSO4 + 2NaOH = Cu(OH)2¯ + Na2SO4; NH4Cl + KOH = KCl + NH4OH
Соли взаимодействуют между собой:
CaCl2 + Na2CO3 = CaCO3¯ + 2NaCl; Pb(NO3)2 + Na2SO4 = PbSO4¯ + 2NaNO3
Все эти реакции протекают в растворах потому, что один из образующихся продуктов нерастворим, улетучивается в виде газа или представляет собой слабый электролит.
Многие соли разлагаются при нагревании с образованием двух оксидов – основного и кислотного:
CaCO3 = CaO + CO2,
а соли аммония с образованием аммиака и хлороводорода:
NH4Cl = NH3 + HCl
Важнейшим химическим свойством солей является их гидролиз. Он рассматривается в главе 4.
4.4. Получение солей
Способы получения солей многочисленны и уже встречались при описании свойств оксидов, оснований и кислот. Тем не менее, рассмотрим их снова с примерами.
Соли образуются при взаимодействии.
1. Металлов с неметаллами: 2Na + Cl2 = 2NaCl; Zn + S = ZnS
2. Основных оксидов с кислотами: СaO + 2HCl = CaCl2 + H2O
3. Кислотных оксидов со щелочами: CO2 + Ba(OH)2 = BaCO3¯ + H2O
4. Амфотерных оксидов с кислотами: SnO + 2HCl = SnCl2 + H2O
5. Амфотерных оксидов со щелочами: SnO + 2KOH = K2SnO2 + H2O
6. Основных оксидов с кислотными: BaO + CO2 = BaCO3
7. Амфотерных оксидов с кислотными оксидами: ZnO + SO3 = ZnSO4
8. Амфотерных оксидов с основными оксидами: ZnO + Na2O = Na2ZnO2
9. Кислот со щелочами (реакция нейтрализации): HCl + NaOH = NaCl + H2O
10. Оснований с кислотами: 2Bi(OH)3 + 3H2SO4 = Bi2(SO4)3 + 6H2O
11. Амфотерных оснований со щелочами: Cr(OH)3 + 3KOH = K3CrO3 + 3H2O
12. Металлов с кислотами: Zn + H2SO4 = ZnSO4 + H2
13. Металлов с солями: Zn + CuSO4 = ZnSO4 + Cu¯
14. Щелочей с солями: 2NaOH + FeCl2 = Fe(OH)2¯ + 2NaCl
15. Кислот с солями: 2HCl + K2SiO3 = H2SiO3¯ + 2KCl
16. Солей с солями: AgNO3 + KBr = AgBr¯ + KNO3
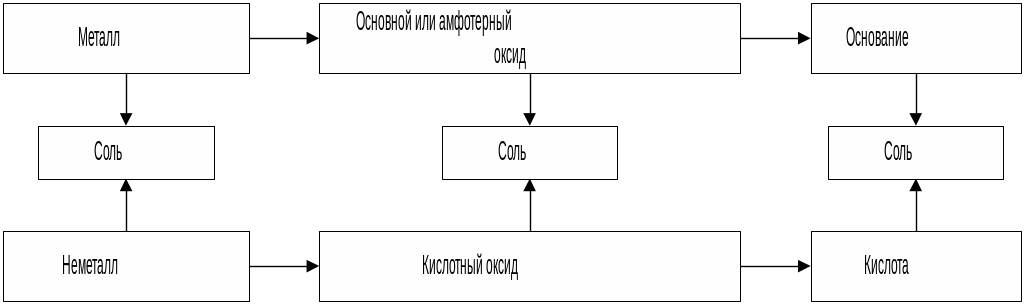
5. Взаимосвязь между классами веществ
Между классами веществ существует возможность их взаимного превращения: из простых веществ получают оксиды, из оксидов – основания или кислоты, из кислот – соли. Возможен и обратный переход от солей к основаниям или кислотам, от оснований или кислот к оксидам, а от оксидов к простым веществам.
Пример . Напишите уравнения реакций для осуществления цепочки превращений:
Ca ® CaO ® Ca(OH)2 ® CaSO4
Решение.
1) 2Ca + O2 = 2CaO 2) CaO + H2O = Ca(OH)2
3) Ca(OH)2 + H2SO4 = CaSO4¯ + H2O
Пример . Напишите уравнения реакций для осуществления цепочки превращений:
P ® P4O10 ® H3PO4 ® KН2PO4 ® K2НPO4 ® K3PO4
Решение.
1) P4 + 5O2 = P4O10 2) P4O10 + 6H2O = 4H3PO4
3) H3PO4 + KOH = KН2PO4 4) KН2PO4 + KOH = K2НPO4
5) K2НPO4 + KOH = K3PO4
Пример . Напишите уравнения реакций для осуществления цепочки превращений:
CuSO4 ® Cu(OH)2 ® CuO ® Cu
Решение.
1) CuSO4 + 2NaOH = Cu(OH)2¯ + Na2SO4
2) Cu(OH)2 = CuO + H2O 3) CuO + H2 = Cu + H2O
Подобная связь классами соединений, позволяющая получать вещество одного класса из вещества другого класса, называется генетической. Но необходимо иметь в виду, что не всегда одно вещество из другого можно получить напрямую. Например, гидроксид меди Cu(OH)2 нельзя получить взаимодействием оксида меди (II) с водой. Тогда применяют косвенный путь: на оксид меди (II) действуют кислотой и получают соль, а из соли действием щелочи получают гидроксид меди.
Генетическую связь между основными классами неорганических соединений можно показать схематически: