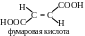- •Тема 1. Введение. Основы современной теории строения органических соединений
- •Теории строения органических соединений
- •Основные положения теории строения органических соединений а.М. Бутлерова
- •Алкены Алкадиены Алкины
- •Тема 2. Химическая связь и взаимовлияние атомов в органических соединениях.
- •Тема 3. Химическое строение и изомерия органических соединений
- •Тема 4. Кислотность и основность органических веществ.
- •Тема 5. Радикальные и электрофильные реакции органических соединений
- •Тема 6. Конкурирующие реакции нуклеофильного замещения и элиминирования у насыщенного атома углерода
- •Тема 7. Нуклеофильные реакции в ряду карбонильных соединений
- •Тема 8. Окислительно-восстановительные реакции органических соединений.
- •Тема 9. Поли- и гетерофункциональные соединения, участвующие в процессах жизнедеятельности
- •Тема 10. Биологически важные гетероциклические соединения
- •Тема 11. Аминокислоты, пептиды, белки
- •Тема 12. Углеводы: моно, ди- и полисахариды
- •Тема 13. Нуклеотиды и нуклеиновые кислоты
- •Тема 14. Липиды и низкомолекулярные биорегуляторы
Тема 3. Химическое строение и изомерия органических соединений
Изомерия органических соединений.
Если два или больше индивидуальных веществ имеют одинаковый количественный состав (молекулярную формулу), но отличаются друг от друга последовательностью связывания атомов или расположением их в пространстве, то в общем случае они называются изомерами. Раз строение этих соединений разное, то и химические или физические свойства изомеров отличаются.
Типы изомерии: структурная (изомеры строения) и стереоизомерия (пространственная).
Структурная изомерия может быть трёх видов:
- изомерия углеродного скелета (изомеры цепи): бутан и 2-метилпропан;
- изомеры положения функциональных групп (или кратных связей): 1-бутанол и 2-бутанол;
- изомеры функциональной группы (межклассовая): 1-бутанол и диэтиловый эфир.
Стереоизомерия подразделяется на конформационную и конфигурационную
Конформации молекулы представляют собой различные её геометрические формы, возникающие в результате вращения вокруг простых -связей.
Конфигурация – это порядок расположения атомов в пространстве без учёта различий, возникающих вследствие вращения вокруг простых -связей.
Конформации органических молекул
Поворот вокруг -связи С–С совершается сравнительно легко, углеводородная цепь может принимать разные формы. Конформационные формы легко переходят друг в друга и поэтому не являются различными соединениями – это разные неустойчивые динамические формы одной и той же молекулы. Разность энергий между конформерами имеет тот же порядок, что и энергия теплового движения (несколько кДж/моль). Поэтому при обычных температурах нельзя выделить отдельные конформеры. Заслоненная и заторможенная конфигурации (выгоднее заторможенная, дальше расстояние между атомами водорода). Молекулы алканов представляют собой смеси конформеров.
Энергетически эти формы очень мало отличаются друг от друга и в результате теплового движения испытывают непрерывные конформационные превращения.



а) б) в)
Рис. 2. а) конформеры пентана б) проекционные формулы Ньюмена
Если же молекулы достаточно длинны, то они скручиваются (спутываются в клубки).
Проекционные формулы Ньюмена. Для изображения конформаций используют проекционные формулы Ньюмена, получающиеся при проецировании на плоскость молекулы С–С- связи. В качестве примера показаны конформации пентана относительно связи С2–С3. Ближайший к наблюдателю атом углерода (С2) обозначают точкой в центре круга; круг при этом символизирует удаленный атом углерода (С3). Три связи от атома изображают в виде линий, расходящихся из центра круга — для ближнего атома (С2) или «высовывающихся» из-за круга — для удаленного атома (С3).Если атомы и группы, связанные с рассматриваемыми атомами углерода как бы заслоняют друг друга, конформация так и называется заслонённой (рис. 2. б), при повороте одного из атомов относительно другого на 60 получаем энергетически более выгодную заторможенную конформацию (рис. 2. в).
Конформации циклических соединений.
Циклопентан. У пятичленного цикла в плоской форме валентные углы равны 108°, что близко к нормальному значению для sр3-гибридного атома. Поэтому в плоском циклопентане, в отличие от циклопропана и циклобутана (углы 60 и 90 0 соответственно) угловое напряжение практически отсутствует, но проявляется торсионное напряжение, которое снижается за счет перехода цикла в неплоскую конформацию конверта (рис. 3.).
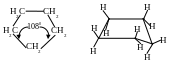
Рис. 3. Конформации циклопентана
В этой конформаций один из атомов углерода выходит из плоскости, в которой расположены остальные четыре атома. Выходящим из плоскости может оказаться любой из пяти атомов и цикл поэтому как бы находится в постоянном волнообразном движении.
Ц и к л о г е к с а н. Шестичленный цикл не может быть плоским из-за наличия сильных углового и торсионного напряжений: в плоском цикле внутренние валентные углы были бы равны 120°, а все атомы водорода находились бы в заслоненном положении.
У циклогексана возникают менее напряженные неплоские конформаций за счет частичного поворота вокруг -связей, среди которых более устойчивыми являются конформаций кресла и ванны (рис. 4). Конформации кресла обозначаются С (от. англ, chair — кресло), а конформации ванны — В (от англ, bath — ванна). Эти конформации свободны от углового напряжения, так как углы в них равны 109,5°.
В кресловидной конформации циклогексана отсутствуют заслоненные положения атомов водорода и углерода: расположение атомов водорода у всех атомов углерода такое же, как в заторможенной конформации этана. Отсутствием углового и торсионного напряжений, а также ван-дер-ваальсова напряжения объясняется относительно наименьшая энергия и большая устойчивость конформации кресла.
Шесть связей С – Н, параллельные оси симметрии кресловидной формы циклогексана, направленные попеременно вверх и вниз, называются аксиальными (символ а). Остальные шесть С – Н связей расположены под углом 109,5° к этой оси и также попеременно направлены вверх и вниз. Эти связи называются экваториальными (символ е). Таким образом, у каждого атома углерода одна связь с атомом водорода расположена аксиально и одна – экваториально.
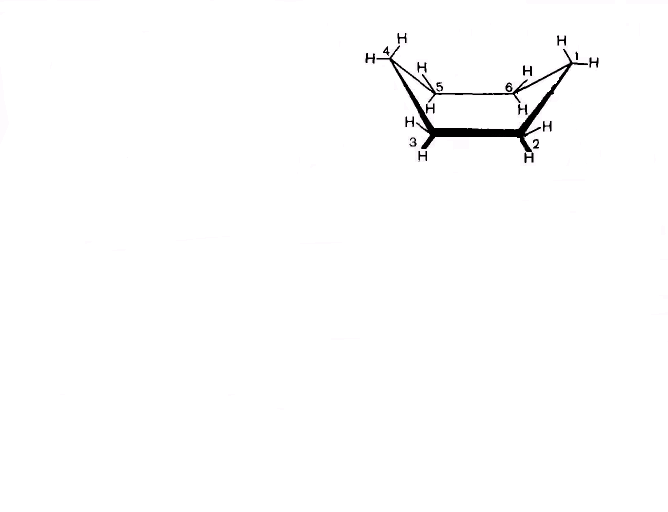
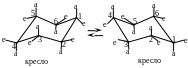
ванна
Рис. 4. Конформации циклогексана – кресло и ванна
Взаимное превращение этих конформаций, а также переход конформации кресла в конформацию ванны происходит через гибкие формы, известные под названиями полукресла и «искаженной» ванны (твист-форма). При переходе от одной конформации к другой меняется потенциальная энергия системы. Максимум энергии соответствует конформации полукресла; минимальной энергией обладает конформация кресла.
Конфигурационные изомеры
Это стереоизомеры с различным расположением вокруг определенных атомов других атомов, радикалов или функциональных групп в пространстве относительно друг друга.
Различают понятия диастереомерии и энантиомерии.
Диастереомерами называются оптически активные изомеры.
Свет представляет собой электромагнитные волны, в которых частицы колеблются во всех направлениях во взаимноперпендикулярных плоскостях и перпендикулярно направлению распространения волны. В плоскополяризованном свете колебания частиц лежат в одной и той же плоскости. Если луч проходит через прозрачное вещество, которое способно повернуть плоскость колебаний электрического поля на некоторый угол и придать им новое направление, то о таком веществе говорят, что оно обладает оптической активностью.
Можно сформулировать 2 признака химической активности органических соединений: наличие асимметрического атома углерода и отсутствие в молекуле элементов симметрии.
Асимметрический атом углерода — атом, связанный с четырьмя различными атомами или группами, обозначающийся звёздочкой: *С.
Для различных молекул могут быть характерны оси или плоскости симметрии. Так, в молекуле трихлорметана (хлороформа) плоскость симметрии проходит через фрагмент Н–С–С1. Существуют, однако, молекулы, не обладающие плоскостью симметрии, которые оказываются несовместимыми со своим зеркальным изображением. Это свойство называется хиральностью, а сами молекулы – хиральными.
Термин «хиральность» означает, что два предмета находятся в таком отношении друг к другу, как левая и правая руки (от греч. cheir — рука), т.е. представляют собой зеркальные изображения, не совпадающие при попытке совместить их в пространстве. В нашем окружении часто встречаются хиральные объекты: пара башмаков, пара перчаток и др. Наглядным примером несовместимости предмета и его зеркального изображения служит невозможность надеть на левую руку правую перчатку, соответствующую пространственному расположению правой руки. Хиральность в первую очередь понятие геометрическое, а не химическое.
Оптически активные изомеры, являющиеся зеркальными отражениями друг друга, называются энантиомерами. Энантиомеры обладают одинаковыми физическими и химическими свойствами, вращают плоскость поляризации плоскополяризованного света на один и тот же угол, но в противоположные стороны. Смесь, состоящая из равных мольных количеств энаантиомеров, называется рацемической смесью или рацематом. Рацемат оптически не активен.
Называют оптические изомеры по R,S или D,L – номенклатурам. R,S- номенклатура описывает абсолютную конфигурацию изомеров, D,L номенклатура – относительную (относительно конфигурации глицеринового альдегида).
В отличие от энантиомеров диастереомеры обладают заметным различием в физических и химических свойствах. Поэтому их можно отделить друг от друга с помощью обычных методов разделения органических веществ.
Понятие диастереомерии охватывает широкий круг стереоизомеров. Среди них следует выделить две группы: -диастереомеры и -диастереомеры.
-Диастереомеры.
Многие биологически важные вещества содержат в молекуле более одного центра хиральности, в них заместители связаны с центром хиральности -связями. Такие диастереомеры называют -диастереомерами. Например, D-рибоза, D-арабиноза, D-ксилоза и D-ликсоза — это -диастереомеры, а D-ликсоза и L-ликсоза – энантиомеры.
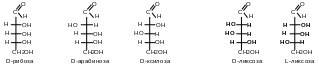
-Диастереомеры (геометрические или цис- транс- изомеры)
К ним относят конфигурационные изомеры, содержащие -связь. Этот вид диастереомерии характерен, в частности, для алкенов. Относительно плоскости -связи одинаковые заместители у двух атомов углерода могут располагаться по одну (цис-) или по разные (транс-) стороны. Основная причина существования цис- и транс-изомеров заключается в невозможности вращения вокруг -связи без ее нарушения.
Цис- и транс-изомеры имеют одинаковую последовательность связывания атомов, но отличаются друг от друга пространственным расположением заместителей и потому являются стереоизомерами. С другой стороны, их молекулы ахиральны (в них нет хиральных центров). Таким образом, цис- и транс-изомеры алкенов относительно друг друга являются диастереомерами и обладают разными свойствами. -Диастереомеры часто встречаются среди природных соединений, в частности для обеспечения остроты зрения особенно важен изомер ретинола (витамин А), в котором все 4 двойные связи находятся в транс-конфигурации.
Контрольные задания
1. Для аланина напишите и назовите все возможные структурные изомеры. Приведите формулу гомолога аланина, для которого возможна изомерия углеродной цепи.
2. Укажите изомеры по положению функциональной группы, назовите их:
а )
СН3-СН-СН3
и СН3-СН2-СН2ОН,
б) СН3-СН2-СН2
и СН3-СН2-СН2Cl,
)
СН3-СН-СН3
и СН3-СН2-СН2ОН,
б) СН3-СН2-СН2
и СН3-СН2-СН2Cl,
ОН NH2 Cl
в) СН3-СН2-СН2NH2 и СН3-СН2-СН2,
г) СН3 – СН2 – СН = СН2 и СН3 – СН = СН – СН3,
д) СН3 – СН2 – СН = СН2 и СН2 = СН – СН2 – СН3.
3. Конформационные изомеры – это:
а) структурные изомеры, отличающиеся положением функциональной группы,
б) стереоизомеры, отличающиеся поворотом частей молекул вокруг -связи,
в) стереоизомеры с различным расположением атомов в пространстве,
г) стереоизомеры, отличающиеся расположением частей молекулы вокруг двойной связи.
4. Приведите пример двух конформеров для любого соединения. Какая из конформаций энергетически более выгодна: 1) заслонённая; 2) ароматическая; 3) заторможенная; 4) расторможенная?
5. Укажите наиболее энергетически выгодную конформацию этандиола:
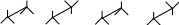 а)
ОН б) Н ОН в) Н г)
Н Н
а)
ОН б) Н ОН в) Н г)
Н Н
ОН ОН ОН ОН
Н Н Н Н ОН ОН
Н Н Н Н Н Н Н Н
6. Выберите и назовите соединения, обладающие оптической активностью:
а) СН3-СН(ОН)-СН2-СН3, б) СН3-СН(Br)-СН3, в) СН3-СН2-СН2ОН,
г) НООС-СН(ОН)-СООН, д) НООС-СН(ОН)-СН2-СООН.
7. Пеницилламин (2-амино-3-меркапто-3-метилбутановая кислота) эффективен в лечении хронического артрита лишь в форме S-изомера. R-Изомер не имеет фармакологического эффекта и является токсичным. Изобразите соединения. Являются ли они энантиомерами?
8. Выберите правильное и полное название конфигурации энантиомера молочной кислоты.
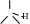 СООН
а) S-2-гидроксипропановая
кислота (абсолютная конфигурация);
СООН
а) S-2-гидроксипропановая
кислота (абсолютная конфигурация);
С б) R-2-гидроксипропановая кислота (абсолютная конфигурация);
НО СН3 в) D-2-гидроксипропановая кислота (относительная конфигурация);
г) L-2-гидроксипропановая кислота (относительная конфигурация);
д) S-2-гидроксипропановая кислота (относительная конфигурация);
е) R -2-гидроксипропановая кислота (относительная конфигурация);
ж) L-2-гидроксипропановая кислота (абсолютная конфигурация);
з) D -2-гидроксипропановая кислота (абсолютная конфигурация).
9. Соединения транс-2-бутен и цис-2-бутен представляют собой:
а) гомологи; б) структурные изомеры;
в) геометрические изомеры; г) изомеры положения кратной связи?
Различаются ли физические свойства цис- и транс-изомеров?
10. На рисунке представлена формула фумаровой кислоты. Приведите структурную формулу малеиновой кислоты, являющейся -диастереомером фумаровой.