
- •Тема 1. Введение. Основы современной теории строения органических соединений
- •Теории строения органических соединений
- •Основные положения теории строения органических соединений а.М. Бутлерова
- •Алкены Алкадиены Алкины
- •Тема 2. Химическая связь и взаимовлияние атомов в органических соединениях.
- •Тема 3. Химическое строение и изомерия органических соединений
- •Тема 4. Кислотность и основность органических веществ.
- •Тема 5. Радикальные и электрофильные реакции органических соединений
- •Тема 6. Конкурирующие реакции нуклеофильного замещения и элиминирования у насыщенного атома углерода
- •Тема 7. Нуклеофильные реакции в ряду карбонильных соединений
- •Тема 8. Окислительно-восстановительные реакции органических соединений.
- •Тема 9. Поли- и гетерофункциональные соединения, участвующие в процессах жизнедеятельности
- •Тема 10. Биологически важные гетероциклические соединения
- •Тема 11. Аминокислоты, пептиды, белки
- •Тема 12. Углеводы: моно, ди- и полисахариды
- •Тема 13. Нуклеотиды и нуклеиновые кислоты
- •Тема 14. Липиды и низкомолекулярные биорегуляторы
Тема 2. Химическая связь и взаимовлияние атомов в органических соединениях.
Электронное строение атома углерода. Гибридизация.
Для валентного электронного слоя атома С, находящегося вглавной подгруппе четвёртой группы второго периода Периодической таблицы Д. И. Менделеева главное квантовое число n = 2, побочное (орбитальное) квантовое число l = 0 (s-орбиталь) и 1 (р-орбиталь); магнитное квантовое число m = 0 (при l = 0) и –1, 0, 1 (при l = 1).
Для того, чтобы привести в соответствие электронную формулу атома С и его валентность, допускают возбуждение внешнего электронного слоя атома углерода. Тогда в атоме С 1s-орбиталь и 3р-орбитали. При перекрывании атомных орбиталей (АО) атомов С и Н три связи С–Н будут одинаковыми, а 4-я должна отличаться по прочности (связь по s- орбитали должна быть менее прочной из-за меньшего перекрывания орбиталей). В действительности это не так. Несоответствие исключается предположением о гибридизации различающихся по форме и энергии АО с появлением гибридных АО. В результате валентные электроны оказываются не на чистых s- и р- орбиталях, а на одинаковых гибридных. Для алканов характерна sр3- гибридизация (участвуют все 4 АО внешнего электронного уровня). В непредельных соединениях одна или две негибридизованные р-орбитали участвуют в образовании -связей, при этом тип гибридизации атома углерода – sр2 для алкенов и sр для алкинов.
Гибридные орбитали алканов располагаются в пространстве симметрично и направлены к вершинам тетраэдра. Связь С–Н образуется перекрыванием s-орбитали атома Н и гибридизованной орбитали атома С, связь С–С образуется за счет перекрывания 2-х гибридизованных орбиталей (направление связи – по оси между атомами). Это - связь.
Свойства -связи:
- относительная химическая инертность вследствие высокой прочности;
- максимум электронной плотности расположен симметрично относительно оси, соединяющей атомы, поэтому возможно свободное вращение вдоль этой оси без изменения перекрывания орбиталей (конформеры);
- длина связи 0,154 нм; угол между направлениями орбиталей 109,5;
- электроотрицательность атома С в sр3-гибридном состоянии = 2,51;
Атом углерода, связанный двойной связью с другим атомом углерода, находится в состоянии sр2-гибридизации. (участвуют 3 АО внешнего электронного уровня). Гибридные орбитали располагаются в пространстве симметрично в одной плоскости, содержащей ядра С. Оставшаяся негибридизированная р-АО ориентирована перпендикулярно этой плоскости. Связь С–Н образуется перекрыванием s-орбитали атома Н и гибридизованной орбитали атома С. Связь С–С образуется за счет перекрывания 2-х гибридизованных орбиталей (направление – по оси между атомами, в плоскости молекулы). Это -связь. Две негибридизованные р-АО перекрываются выше и ниже плоскости молекулы – образуется -связь.
Отличие двойной связи от одинарной:
- расстояние между атомами углерода при двойной связи меньше, чем при одинарной (0,134 нм); угол между гибридными АО 120;
- электроотрицательность гибридизованного атома С = 2,69;
- затрудненное вращение вокруг линии, соединяющей атомы С;
- двойная связь более прочна, т.к. увеличивается электронная плотность на связывающих МО между атомами углерода (термическая стойкость этилена выше, чем этана);
- высокая реакционная способность -связи, что объясняется большей подвижностью электронов вне плоскости молекулы;
- повышенная электронная плотность по сравнению с одинарной связью, причем на периферии молекулы. Это приводит к тому, что к двойной связи притягиваются положительно заряженные ионы или полярные молекулы своим положительным полюсом.
Связи С–Н в ацетилене относятся к числу -связей, образованных путем перекрывания s-орбитали водорода с гибридизованной sp-орбиталью углерода; в молекуле имеется одна углерод-углеродная -связь (образованная перекрыванием двух гибридизованных sp-орбиталей углерода) и две углерод-углеродные -связи (результат перекрывания двух взаимно перпендикулярных пар негибридизованных р-орбиталей (ру и рz)атомов углерода).
Свойства тройной связи:
- атомы углерода, связанные тройной связью, имеют электроотрицательность = 2,75;
- длина СС-связи = 0,120 нм;
- валентные углы в ацетилене на основании этой модели равны 180° и молекула имеет линейную конфигурацию, что делает невозможной цис-транс-изомерию при тройной связи;
- связь сильно поляризована, т.к. в sр- гибридной форме углеродный атом сильнее удерживает электроны, чем в sр2 и sр3 – гибридных формах; следовательно; электронная пара СН-связи в молекуле ацетилена ближе к ядру С, чем в случае этилена, атом Н более подвижен, обладает слабыми кислотными свойствами (в отличие от алканов и алкенов).
Сопряженные системы
Различают два типа сопряженных систем (и сопряжений).
1 .
,
-сопряжение
— электроны делокализованы между двумя
(и более) кратными связями. Например, в
делокализации электронов в молекуле
бутадиена участвуют четыре атома
углерода: СН2=СН–СН=СН2
СН2–СН–СН–СН2
.
,
-сопряжение
— электроны делокализованы между двумя
(и более) кратными связями. Например, в
делокализации электронов в молекуле
бутадиена участвуют четыре атома
углерода: СН2=СН–СН=СН2
СН2–СН–СН–СН2
В![]() молекуле бензола делокализация происходит
с участием 6 атомов углерода (три двойные
связи, каждую образует 2 электрона, по
одному от каждого атома):
молекуле бензола делокализация происходит
с участием 6 атомов углерода (три двойные
связи, каждую образует 2 электрона, по
одному от каждого атома):
Кроме того, при осуществлении «кругового» сопряжения, как в бензоле, система получает дополнительный существенный выигрыш энергии, называемый энергией сопряжения. Например, энергия сопряжения молекулы бензола равна 15 кДж/моль.
2. р, -сопряжение — в делокализации принимают участие электроны -связи и р-орбитали гетероатома; например, в молекулах ацетамида и пиррола:
![]()
В случае молекулы ацетамида в делокализации участвуют три атома (С, О, N); в случае молекулы пиррола — пять атомов (4 атома С и атом N). Чем длиннее система сопряжения, тем более она устойчива. Ароматическая система представляет собой устойчивую плоскую циклическую сопряженную полиеновую структуру, содержащую (4п + 2) -электронов (п = 1, 2, 3, ...). Например, бензол – ароматическая структура (6 -электронов), а 1,3,5,7-циклооктатетраен – нет (8 -электронов).
Делокализация электронов является одним из важных факторов повышения устойчивости молекул и ионов, поэтому это явление широко распространено в биологически важных молекулах (витамины, гем, хлорофилл, гемоглобин и др.).
Витамин А относится к сесквитерпенам (терпены – 10 углеродов и 3 дв. связи), содержится в масле, молоке, яичном желтке, рыбьем жире; свиное сало и маргарин его не содержат. Это витамин роста; недостаток его в пище вызывает убыль в весе, высыхание роговицы глаз, понижение сопротивляемости к инфекции. Витамин А заменяют каротином (тритерпен) С40Н56, (пигмент моркови); в организме человека каротин превращается в витамин А.

 Н3С
Н3С
Н 3С
СН3
СН3
СН3
3С
СН3
СН3
СН3
 СН=СН–С=СН–СН=СН–С=СН–СН=СН–СН=С–СН=СН–СН=С–СН=СН–
СН=СН–С=СН–СН=СН–С=СН–СН=СН–СН=С–СН=СН–СН=С–СН=СН–
СН3 СН3
СН3 -каротин Н3С СН3
Н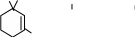 3С
СН3
СН3
СН3
3С
СН3
СН3
СН3
 СН=СН–С=СН–СН=СН–С=СН–СН2
– ОН
СН=СН–С=СН–СН=СН–С=СН–СН2
– ОН
СН3 витамин А
В молекуле хлорофилла также присутствует развитая система сопряжённых связей – 4 остатка пиррола, образующих вместе порфириновое ядро, связанное с атомом магния. Хлорофилл — сложный эфир двухосновной кислоты и спиртов — метанола и фитола С20Н39ОН. По строению он близок к дыхательным ферментам (каталазе, пероксидазе) и к красящему веществу крови — гему.
Типы атомов углерода. Атомы, соединенные с одним углеродным атомом называются первичными, соответственно называются первичными и три атома водорода у первичного углеродного атома. Атом углерода, соединенный с двумя атомами углерода называется вторичным, а два атома водорода у него называются вторичными атомами водорода. Атом, соединенный с тремя другими атомами С, называется третичным, как и единственный атом водорода при нем; а атом углерода, связанный с четырьмя атомами С – четвертичным.
Электронные эффекты (индуктивный и мезомерный)
Поляризация молекулы обусловлена различным влиянием атомов, входящих в состав молекулы. Атомы с большой электроотрицательностью притягивают к себе электроны -связей. Такой вид поляризации (сдвиг электронной плотности -связи под действием разности в электроотрицательности связанных атомов) называется индуктивным эффектом (обозначается заглавной латинской буквой I и прямой стрелкой ()). Если в связи СХ электронная плотность сдвинута в сторону заместителя Х по сравнению со связью СН, то такое влияние заместителя называют отрицательным индуктивным эффектом (I). Если же смещение происходит в сторону атома С по сравнению со связью СН, то такое действие заместителя называют положительным индуктивным эффектом (+I). При передаче по цепи индуктивный эффект затухает.
 Н
Н
Н
Н

 Н
С+2
С+1
Сl +2
< +1
Н
С+2
С+1
Сl +2
< +1
Н Н
+I- Эффектом характеризуются алкильные радикалы, -I эффектом– атомы галогенов, функциональные группы, содержащие кислород, азот, серу, кратные связи, а также группы, несущие положительный заряд.
Если в молекуле имеются системы сопряженных простых и кратных связей или атомы с неподеленными электронными парами, включенными в систему сопряжения, они могут участвовать в образовании общего -электронного облака. Участие групп в сопряжении и влияние их на состояние -электронного облака молекулы называют мезомерным эффектом (сдвиг электронной плотности сопряжённых -связей) , или эффектом сопряжения (обычно обозначается заглавной буквой М; реже – заглавной буквой С). Для его обозначения используется изогнутая стрелка. У атомов азота, кислорода, фтора внешняя электронная оболочка заполнена, и они способны смещать p-электроны неподеленной электронной пары в сторону бензольного ядра или ненасыщенного углеродного атома:
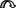

СН3 О СН = СН2
Если в систему сопряжения входит кратная связь между разнородными атомами, то общее -электронное облако смещается в сторону более электроотрицательного атома:
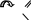 O
O
СН2 = СНC+
Н
Положительный мезомерный эффект проявляют группы: –ОН; –OR; –NH2; NR2; –SH; галогены (смещение электронной плотности от гетероатома); отрицательный: группы NO2, CN, СООН, SО3Н (смещение электронной плотности к гетероатому функциональной группы). Наличие индуктивного и мезомерного эффектов приводит к перераспределению электронной плотности в молекуле. В результате на одних атомах концентрируется частичный отрицательный, а на других – частичный положительный заряды. В свою очередь, это перераспределение зарядов определяет реакционную способность соединений, их кислотно-основные свойства, дипольный момент молекул, силу межмолекулярных связей (а значит и такие свойства как темперутуры кипения и плавления, растворимость).
Контрольные задания
1. Выберите углеводород, в молекулах которого орбитали всех атомов углерода находятся в состоянии sр3- гибридизации:
а) пропен; б) 1-бром-2-бутен; в) 2,2-диметилпропан; г) пропин.
2. Определите тип гибридизации каждого атома углерода в коричной кислоте.
3. Напишите структурную формулу ментола (2-изопропил-5-метил-циклогексанол). Определите тип гибридизации каждого атома углерода в ментоле.
4. Сопряжённые системы – это соединения, содержащие:
а) две или несколько кратных связей, отделённых друг от друга одной простой связью;
б) две или несколько простых связей, отделённых друг от друга одной кратной связью;
в) только кратные связи; г) только простые связи.
5. К какому типу диенов относится 1,3-бутадиен:
а) сопряженные; б) кумулированные; в) изолированные?
6 .
Назовите приведённые ниже соединения.
Какие из них являются ароматическими,
а какие – нет и почему?
.
Назовите приведённые ниже соединения.
Какие из них являются ароматическими,
а какие – нет и почему?
а) б) –СН3 в) –СН3 г)
Сформулируйте признаки ароматичности соединений.
9. Выберите и назовите соединения, в которых гидроксильная группа является электронодонорным заместителем:
а )
СН3СН2СН2ОН,
б) ОН– –NO2,
в) НОСН2СН2СН2ОН,
г) НОСН2СН2СООН.
)
СН3СН2СН2ОН,
б) ОН– –NO2,
в) НОСН2СН2СН2ОН,
г) НОСН2СН2СООН.
10. Какой электронный эффект (эффекты) проявляет гидроксильная группа в глицерине:
а) положительный индуктивный, б) отрицательный индуктивный,
в) положительный мезомерный, г) отрицательный мезомерный?
11. Укажите электронные эффекты (эффект) аминогруппы в анилине:
1) положительный мезомерный; 2) отрицательный мезомерный;
3) положительный индуктивный; 4) отрицательный индуктивный; 5) нет эффектов.
