
- •Тема 1. Введение. Основы современной теории строения органических соединений
- •Теории строения органических соединений
- •Основные положения теории строения органических соединений а.М. Бутлерова
- •Алкены Алкадиены Алкины
- •Тема 2. Химическая связь и взаимовлияние атомов в органических соединениях.
- •Тема 3. Химическое строение и изомерия органических соединений
- •Тема 4. Кислотность и основность органических веществ.
- •Тема 5. Радикальные и электрофильные реакции органических соединений
- •Тема 6. Конкурирующие реакции нуклеофильного замещения и элиминирования у насыщенного атома углерода
- •Тема 7. Нуклеофильные реакции в ряду карбонильных соединений
- •Тема 8. Окислительно-восстановительные реакции органических соединений.
- •Тема 9. Поли- и гетерофункциональные соединения, участвующие в процессах жизнедеятельности
- •Тема 10. Биологически важные гетероциклические соединения
- •Тема 11. Аминокислоты, пептиды, белки
- •Тема 12. Углеводы: моно, ди- и полисахариды
- •Тема 13. Нуклеотиды и нуклеиновые кислоты
- •Тема 14. Липиды и низкомолекулярные биорегуляторы
Тема 9. Поли- и гетерофункциональные соединения, участвующие в процессах жизнедеятельности
Подавляющее большинство органических веществ, участвующих в процессах метаболизма, представляют собой соединения с двумя и более функциональными группами. Такие соединения принято классифицировать следующим образом:
1 )
полифункциональные, содержащие одинаковые
функциональные группы, например:
этиленгликоль СН2ОН
– СН2ОН,
гидрохинон НО– –ОН, щавелевая
кислота НООС–СООН;
)
полифункциональные, содержащие одинаковые
функциональные группы, например:
этиленгликоль СН2ОН
– СН2ОН,
гидрохинон НО– –ОН, щавелевая
кислота НООС–СООН;
2 ) гетерофункциональные, содержащие различные функциональные группы, например: коламин СН2ОН–CH2NH2, п-аминобензойная кислота H2N– –СООН, пировиноградная кислота СН3–С(О) –СООН;
3) гетерополифункциональные, например: различные моносахариды, яблочная кислота
НООС–СН(ОН) –СН2-СООН.
Наличие нескольких функциональных групп в молекуле оказывает значительное влияние на химические свойства соединения, приводя, с одной стороны, к усилению или ослаблениию реакционной способности соединений, а с другой – к появлению нехарактерных для монофункциональных соединений специфических свойств. Последние являются наиболее важными для обеспечения биологических функций, выполняемых этими веществами в организме.
Кислотно-основные свойства. Выполняется общая закономерность: наличие в молекуле групп ОН, SH, СООН приводит к усилению ее кислотных свойств, а аминогрупп NH2, NH – к усилению основных свойств. Кроме того, наличие дополнительной электроноакцепторной группы вблизи кислотного центра влечет за собой повышение кислотности соединения. Так, этиленгликоль СН2ОН–СН2ОН проявляет более сильные кислотные свойства по сравнению с этанолом СН3–СН2ОН; щавелевая кислота НООС–СООН является более сильной кислотой, чем уксусная СН3–СООН, а молочная кислота СН3–СН(ОН) –СООН – более сильной, чем пропановая СН3–СН2–СООН.
Во всех перечисленных случаях отрицательный индуктивный эффект заместителей (-I-эффект) вблизи групп ОН и СООН обусловливает значительную поляризацию связи О–Н и легкость отщепления протона, т. е. усиление кислотных свойств. Аналогично, замена метильной группы СН3 в ацетамиде на аминогруппу в карбамиде (мочевине):

приводит к усилению основных свойств, что можно проиллюстрировать реакцией с соляной кислотой (образуется соль – гидрохлорид мочевины):
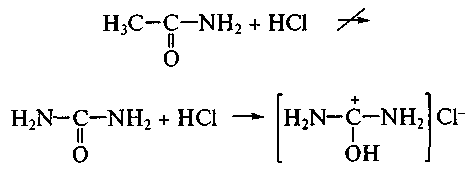
Еще более сильные по сравнению с карбамидом основные свойства проявляет гуанидин:
 NH
NH
NH2–C–NH2
Наконец, наличие в молекуле различных по кислотно-основным свойствам функциональных групп обусловливает амфотерные свойства соединений. Предельным случаем является полный перенос протона от кислотного центра к основному, например в -аминокислотах, которые в кристаллическом состоянии, а так же в нейтральном водном растворе существуют в форме цвиттер-иона (биполярного иона, внутренней соли): H3N+–CH(R) –COO–.
Нуклеофильно-электрофильные свойства. Выполняется общая закономерность, а именно: наличие электроноакцепторного заместителя (-I-эффект) облегчает протекание нуклеофильных реакций и затрудняет протекание электрофильных реакций. Так, в присутствии карбоксильной группы атом галогена, например в - галогенкарбоновых кислотах, легко замещается не только на гидроксильную группу (при взаимодействии со щелочами), но и на аминогруппу (при взаимодействии с аммиаком):
R -CH-COOH
+ 3NH3
R-CH-COONH4
+ NH4C1
-CH-COOH
+ 3NH3
R-CH-COONH4
+ NH4C1
Cl NH2
Приведенная реакция протекает по механизму SN, давая соли -аминокислот.
В ,-ненасыщенных карбоновых кислотах близость электроноакцептора (карбоксильной группы) приводит к протеканию реакций присоединения по двойной С-С связи по нуклеофильному (AN) механизму; реакции же электрофильного присоединения затруднены.
Реакции циклизации. Относятся к специфическим реакциям гетерофункциональных соединений и могут протекать как внутримолекулярно, так и межмолекулярно в зависимости от удаленности функциональных групп друг от друга.
Внутримолекулярная циклизация. Выполняется общая закономерность: реакции характерны для гетерофункциональных соединений с - и -положением функциональных групп. Нуклеофильный и электрофильный реакционные центры находятся внутри одной молекулы и оказываются сближенными в пространстве за счет существования молекулы в «свернутой» (клешневидной) конформации.
В результате реакций внутримолекулярной циклизации могут образоваться циклические полуацетали из альдегидоспиртов по механизму AN:

циклические эфиры – лактоны – из гидроксикислот по механизму SN с участием sр2-гибридизованного атома углерода
циклические амиды – лактамы – из аминокислот по механизму SN с участием sр2-гибридизованного атома углерода:
Реакции идут самопроизвольно уже при незначительном наггревании. Образующиеся циклические продукты подвергаются гидролизу в кислой и щелочной среде с образованием соответствующих солей.
Межмолекулярная циклизация. Выполняется общая закономерность: реакции характерны для замещенных кислот, проходят по механизму межмолекулярного элиминирования и сопровождаются образованием устойчивых шестичленных циклов – циклических диэфиров – лактидов из -гидроксикислот; например, образование лактида молочной кислоты или циклических диамидов – дикетопиперазидов из -аминокислот:

Реакции комплексообразования. Выполняется общая закономерность: поли- и гетерофункциональные соединения с -положением функциональной группы выступают в роли бидентатных или полидентатных лигандов при взаимодействии с ионами переходных металлов с образованием внутрикомплексных соединений – хелатов.
Реакции хелатообразования являются специфическим свойством поли- и гетерофункциональных соединений; чрезвычайно широко распространены и играют существенную роль в процессах метаболизма. Один из примеров – образование внутрикомплексной соли – глицината меди – при взаимодействии в растворе амино-уксусной кислоты с солями меди(П):
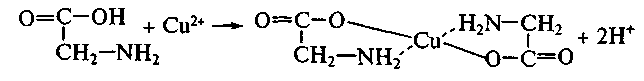
Хелаты представляют собой устойчивые циклические комплексные соединения. Большинство ионов биометаллов в организме находятся в виде хелатных комплексов с органическими биолигандами. Одним из примеров таких соединений является гемовая структура (гем), представленная на рисунке.
Многоатомные спирты.
В соответствии с числом гидроксильных групп, входящих в их состав, различают одноатомные, двухатомные и т. д. спирты. Двухатомные спирты, т. е. спирты, содержащие две гидроксильные группы, носят общее название диолы, или гликоли. Трехатомные спирты называют триолами, или глицеринами; спирты с большим числом гидроксильных групп носят общее название полиолы.
Простейшие и наиболее важные представители диолов и триолов – этиленгликоль и глицерин соответственно.
Многоатомные спирты обладают большей кислотностью по сравнению с одноатомными, что является следствием - I- эффекта одной гидроксильной группы по отношению к другой. Многоатомные спирты по свойствам в значительной степени напоминают одноатомные. Гидроксильные группы в них могут первичными, вторичными и третичными, причем в реакции может вступать одна или несколько гидроксильных групп. Многоатомные спирты с гидроксидами некоторых тяжелых металлов в щелочной среде образуют внутрикомплексные (хелатные) соединения, имеющие характерное окрашивание. В частности, при взаимодействии с гидроксидом меди(II) возникает интенсивное синее окрашивание.
Дегидратация этиленгликоля в специальных условиях приводит к макроциклическим полиэфирам, так называемым к р а у н - э ф и р а м. Краун-эфиры весьма перспективные комплексообразователи, своеобразные ловушки катионов. В определенной степени они моделируют действие некоторых веществ (например, антибиотика пептидной природы валиномицина), облегчающих транспорт ионов через клеточные мембраны. Примером может служить полиэфир 18-краун-6, образующий прочный комплекс с ионом калия.
Примерами многоатомных спиртов высшей атомности служат пентиты и гекситы – соответственно пяти- и шестиатомные спирты с открытой цепью. Накопление гидроксильных групп в молекуле ведет к появлению сладкого вкуса.
П редставители
пентитов и гекситов – ксилит и сорбит
– заменители сахара для больных диабетом.
Инозиты – шестиатомные спирты
циклогексанового ряда.
В
связи с наличием асимметрических атомов
углерода у инозита существует несколько
стереоизомеров.
редставители
пентитов и гекситов – ксилит и сорбит
– заменители сахара для больных диабетом.
Инозиты – шестиатомные спирты
циклогексанового ряда.
В
связи с наличием асимметрических атомов
углерода у инозита существует несколько
стереоизомеров.
Справа приведена кресловидная информация мезоинозита (в которой пять из шести гидроксильных групп находятся в экваториальном положении).
Мезоинозит относится к витаминоподобным соединениям (витамины группы В) и является структурным компонентом сложных липидов. В растениях широко распространена фитиновая кислота, представляющая собой гексафосфат мезоинозита. Ее кальциевая или смешанная кальций магниевая соль, называемая фитином, стимулирует кроветворение, улучшает нервную деятельность при заболеваниях, связанных с недостатком фосфора в организме.
Двухатомные фенолы
Двухатомные фенолы – пирокатехин, резорцин, гидрохинон – входят в состав многих природных соединений. Все они дают характерное окрашивание с хлоридом железа. Пирокатехин (о-дигидроксибензол, катехол) является структурным элементом многих биологически активных веществ в частности катехоламинов. Его монометиловый эфир гваякол, применяется как лекарственное средство при катаре верхних дыхательных путей.
Резорцин (м-дигидроксибензол) используется при лечении кожных заболеваний в составе примочек или мазей.
Гидрохинон (п-дигидроксибензол) применяется как проявитель в фотографии. В организме восстановительная способность замещенного гидрохинонового фрагмента делает его участником важного процесса транспорта электронов от окисляемого субстрата к кислороду. Сама гидрохиноновая группировка окисляется при этом в хиноидную.
Простейшим диамином является этилендиамин. Он образуется при аммонолизе 1,2-дихлорэтана или этиленимина.
Тетраметилендиамин (путресцин) и пентаметилендиамин (кадаверин) длительное время считали трупными ядами, т. е. соединениями, образующимися при декарбоксилировании диаминокислот и обусловливающими ядовитость гниющих белков.
H2NCH2CH2CH2CH2NH2 Н2NСН2СН2СН2СН2СН2МН2
Путресцин Кадаверин
В настоящее время выяснено, что ядовитые свойства белкам при гниении придают другие вещества.
Дикарбоновые и ненасыщенные карбоновые кислоты.
Карбоновые кислоты, содержащие в своем составе одну карбоксильную группу, называют одноосновными, две — двухосновными т. д.
Дикарбоновые кислоты – белые кристаллические вещества, обладающие более кислым характером, чем монокарбоновые ты. Дикарбоновые кислоты образуют два ряда функциональных производных – по одной и двум карбоксильным группам; получить их можно общими для карбоновых кислот методами.
Щавелевая кислота НООС–СООН – простейшая двухосновная кислота. Ее соли называют оксалатами. Некоторые из них трудно растворимы и часто образуют камни в почках и мочевом пузыре (оксалатные камни). К таким солям относится оксалат кальция. При нагревании с серной кислотой щавелевая кислота разлагается с образованием СО.
Малоновая кислота НООС–СН2–СООН и ее производные по метиленовой группе легко декарбоксилируются при нагревании выше 100 °С. Эта реакция лежит в основе общего способа получения замещенных производных уксусной кислоты
Янтарная кислота в заметном количестве находится в янтаре – отсюда она и получила свое название. Некоторые ее производные, например имид (сукцинимид) и соли (сукцинаты), называют с учетом латинского названия янтаря.
Окисление (дегидрирование) янтарной кислоты в фумаровую, катализируемое ферментом сукцинатдегидрогеназой, осуществляется с участием кофермента ФАД. Реакция протекает стереоспецифично с отщеплением атомов водорода и образованием фумаровой кислоты.
Аминоспиртами называют соединения, содержащие в молекуле одновременно амино- и гидроксигруппы.
У одного атома углерода эти группы удерживаются непрочно (происходит отщепление аммиака с образованием карбонильного соединения или воды с образованием имина). Поэтому простейшим представителем аминоспиртов является 2-аминоэтанол, соединение, в котором две функциональные группы расположены у соседних атомов углерода.
Аминоспирты
2-Аминоэтанол (этаноламин, коламин) – структурный компонент сложных липидов, образуется путем размыкания напряженных трехчленных циклов этиленоксида и этиленимина аммиаком или водой соответственно (реакции нуклеофильного замещения).
Холин (триметил-2-гидроксиэтиламмоний) — структурный элемент сложных липидов. Имеет большое значение как витаминоподобное вещество, регулирующее жировой обмен.
В организме холин может образоваться из аминокислоты серина. При этом сначала в результате декарбоксилирования серина получается 2-аминоэтанол (коламин), который затем подвергается исчерпывающему метилированию при участии S-аденозилметионина (SAM).
В результате окисления свободного холина in vivo образуется биполярный ион бетаин, который может служить источником метильных групп в реакциях трансметилирования.
Биологическая роль сложных эфиров холина. Замещенные фосфаты холина являются структурной основой фосфолипидов — важнейшего строительного материала клеточных мембран.
Сложный эфир холина и уксусной кислоты — ацетилхолин — наиболее распространенный посредник при передаче нервного возбуждения в нервных тканях (нейромедиатор). Он образуется в организме при ацетилировании холина с помощью ацетил кофермента А.
При ингибировании ацетилхолинэстеразы ацетилхолин накапливается в организме, что приводит к непрерывной передаче нервных импульсов и соответственно непрерывному сокращению мышечной ткани. На этом основано действие инсектицидов (химических средств уничтожения насекомых) и нервно паралитических ядов — зарина, табуна — фосфорорганических соединений, которые, реагируя с остатком серина, содержащимся в активном центре ацетилхолинэстеразы, ингибируют действие этого фермента.
В медицинской практике используется ряд производных холина.
Ацетилхолин хлорид применяется в качестве сосудорасширяющего средства. Карбамоилхолинхлорид (карбахолин) — холинуретан, сложный эфир холина и карбаминовой кислоты, не гидролизуется холинэстеразой и поэтому активнее холина и обладает более продолжительным действием. Сукцинил-холиниодйд (дитилин) — сложный эфир холина и янтарной кислоты, оказывает мышечно-расслабляющий эффект.
Важную роль в организме играют аминоспирты, содержащие в качестве структурного фрагмента остаток пирокатехина. Они носят общее название катехоламинов.
Катехоламины — представители биогенных аминов, образующихся в организме в результате процессов метаболизма. К катехоламинам относятся дофамин, норадреналин и адреналин, выполняющие, как и ацетилхолин, роль нейромедиаторов. Адреналин является гормоном мозгового вещества надпочечников. Адреналин участвует в регуляции сердечной деятельности. При физиологических стрессах он выделяется в кровь («гормон страха»). Активность адреналина связана с конфигурацией хирального центра, определяющей взаимодействие с рецептором.
Подобно 1,2-дигидроксибензолу, катехоламины с раствором хлорида железа (III) дают изумрудно-зеленое окрашивание, переходящее в вишнево-красное при добавлении раствора амиака, что может служить качественной реакцией на эти соединения.
Структурно близки катехоламинам некоторые природные и синтетические биологически активные вещества, применяемые в производстве лекарственных средств. Примерами служат алкалоид иофедрин, оказывающий сосудорасширяющее действие, и синтетический препарат мезатон, повышающий, подобно норадреналину, артериальное давление. Оба вещества применяются в виде гидрохлоридов.
Гидрокси- и аминокислоты.
Гидроксикислоты содержат в молекуле одновременно гидроксильную и карбоксильную группы, аминокислоты — карбоксильную и аминогруппу.
В зависимости от расположения гидрокси- или аминогруппы по отношению к карбоксилу различают -, -, - и т. д. гидроксикислоты или аминокислоты.
-Гидрокси и а-аминокислоты. При нагревании эти соединения претерпевают межмолекулярную дегидратацию с образованием шестичленных кислород- и азотсодержащих гетероциклов — лактидов и дикетопиперазинов соответственно.
-Гидроксикислоты способны разлагаться при нагревании в присутствии минеральных кислот с образованием карбонильных соединений и муравьиной кислоты.
Гликолевая кислота НОСН2СООН — простейший представитель гидроксикислот. Встречается во многих растениях, например свекле и винограде.
Молочная кислота СН3СН(ОН)СООН — одна из важнейших гидроксикислот. Широко распространена в природе как продукт молочнокислого брожения лактозы, содержащейся в молоке, и других углеводов, входящих в состав овощей и плодов. Кислое молоко, кефир, кислая капуста, моченые яблоки и т. д. содержат в значительном количестве молочную кислоту, образующуюся в результате жизнедеятельности молочнокислых бактерий. Соли называют лактаты.
Молочная кислота содержит асимметрический атом углерода, поэтому может существовать в виде двух энантиомерных форм. В организме L-(+)-молочная кислота, называемая также мясомолочной кислотой, является одним из продуктов превращения глюкозы (гликолиза). Она накапливается в мышцах при интенсивной работе, вследствие чего в них возникает характерная боль. Причина накопления молочной кислоты – недостаток кислорода, что вызывает восстановление пировиноградной кислоты в молочную с участием кофермента НАДН.
Оксокислоты
Оксокислоты — соединения, содержащие одновременно карбоксильную и альдегидную (или кетонную) группы. В соответствии с этим различают альдегидокислоты и кетокислоты.
Простейшей альдегидокислотой является глиоксиловая кислота НООС—СНО.
Она содержится в недозрелых фруктах, но по мере созревания ее количество уменьшается. Глиоксиловая кислота обычно существует в виде гидрата НООС—СН(ОН)2. Электроноакцепторная карбоксильная группа в глиоксиловой кислоте, подобно трихлорметильной группе хлораля, создает значительный дефицит электронной плотности и соседнем атоме углерода, в результате чего две гидроксильные группы при нем удерживаются достаточно прочно. Важную роль в биохимических процессах играют следующие кетонокислоты.
Пировиноградная, щавелевоуксусная и -оксоглутаровая кислоты участвуют в цикле трикарбоновых кислот. Ацетоуксусная кислота относится к -кетонокислотам. При переаминировании -кетонокислоты образуют соответствующие -аминокислоты.
Пировиноградная кислота СН3С(О)СООН (т. пл. 14 °С, т. кип. 165 °С) — одно из центральных соединений в цикле трикарбоновых кислот. Она является также одним из промежуточных продуктов при молочнокислом и спиртовом брожении углеводов. Может быть получена при взаимодействии ацетилхлорида с цианидом калия с последующим гидролизом образующегося кетононитрила или путем окисления молочной кислоты.
Своим названием пировиноградная кислота обязана тому, что впервые была выделена при пиролизе виноградной кислоты. Ее соли называют пируватами. Пировиноградная кислота легко декарбоксилируется при нагревании с разбавленной и декарбонилируется — с концентрированной серной кислотой. При окислении пировиноградная кислота превращается в уксусную кислоту и оксид углерода (IV).
Декарбоксилирование пировиноградной кислоты in vivo протекает в присутствии фермента декарбоксилазы и соответствующего кофермента. Получающийся при этом ацетальдегид, не теряя связи с коферментом («активный ацетальдегид»), может присоединяться к - кетонокислотам, образуя -ацето--гидроксикислоты. Пировиноградная кислота сильнее уксусной и способна к енолизации. Важное её производное – фосфоенолпировиноградная кислота (фосфат енольной формы пировиноградной кислоты). В организме анион этой кислоты – фосфоенолпируват – образуется в процессе гликолиза и служит предшественником пирувата.
Ацетоуксусная кислота СН3С(О)СН2СООН — пример -кетонокислоты. В свободном состоянии представляет сиропообразную жидкость, уже при комнатной температуре медленно выделяющую диоксид углерода. Получающийся при этом ацетон образуется первоначально в енольной форме. Подобное декарбоксилирование – общее свойство -кетонокислот.
Ацетоуксусная кислота образуется in vivo в процессе метаболизма высших жирных кислот и как продукт окисления -гидроксимасляной кислоты наряду с продуктами ее превращений накапливается в организме у больных сахарным диабетом (так называемые «ацетоновые» или «кетоновые» тела).
Большое теоретическое значение в связи с вопросами таутомерии и двойственной реакционной способности имеет этиловый эфир ацетоуксусной кислоты СН3С(О)СН2СООС2Н5, так называемый ацетоуксусный эфир.
Ацетоуксусный эфир — бесцветная жидкость (т. кип. 181 °С) с приятным фруктовым запахом. Впервые синтезирован более 100 лет назад, его строение долгое время было предметом острых дискуссий. Основная трудность заключалась в том, что в результате его химических превращений получались два ряда производных – ацетоуксусной и - гидроксикротоновой кислот, т.е. ацетоуксусный эфир оказался веществом, проявляющим двойственную реакционную способность.
В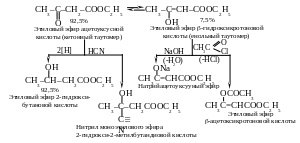 соответствии со строением ацетоуксусного
эфира (вещества, имеющего кетонную
группу) протекают реакции присоединения
циановодородной кислоты и восстановления.
Однако под действием натрия, гидроксида
натрия или при ацилировании в определенных
условиях образуются производные
-гидроксикротоновой
кислоты,
т. е. соединения с енольной группой.
Исследования показали, что ацетоуксусный
эфир представляет смесь двух изомеров
– кетона (95 %) и енола (5 %), находящихся в
таутомерном равновесии. Это еще один
пример кето-енольной таутомерии.
соответствии со строением ацетоуксусного
эфира (вещества, имеющего кетонную
группу) протекают реакции присоединения
циановодородной кислоты и восстановления.
Однако под действием натрия, гидроксида
натрия или при ацилировании в определенных
условиях образуются производные
-гидроксикротоновой
кислоты,
т. е. соединения с енольной группой.
Исследования показали, что ацетоуксусный
эфир представляет смесь двух изомеров
– кетона (95 %) и енола (5 %), находящихся в
таутомерном равновесии. Это еще один
пример кето-енольной таутомерии.
При действии на ацетоуксусный эфир какого-либо реагента в реакцию вступает один из таутомеров. Поскольку второй таутомер за счет равновесия восполняет убыль реагирующего таутомера, то таутомерная смесь реагирует в данном направлении
Скорость установления таутомерного равновесия может быть оценена на основании изучения взаимодействия ацетоуксусного эфира с бромом в присутствии хлорида железа(III). Ацетоуксусный эфир как енол образует с хлоридом железа характерное фиолетовое окрашивание. Если к этому окрашенному раствору прибавлять по каплям бром то енольный таутомер, присоединяя бром по двойной связи, переходит в бромпроизводное и окраска исчезает. Однако чернз некоторое время окраска вновь появляется, так как нарушенное равновесие восстанавливается и кетонный мономер частично переходит в енольную форму. Опыт можно вторить несколько раз, пока все взятое количество ацетоуксусного эфира не прореагирует с бромом.
Ацетоуксусный эфир широко применяется в органическом синтезе как исходное вещество для получения кетонов, карбоновых кислот, гетерофункциональных соединений, в том числе производных гетероциклов, представляющих интерес в качестве лекарственных средств.
Гетерофункциональные производные бензола как лекарственные средства.
Последние десятилетия характеризуются появлением множества новых лекарственных средств и препаратов. Вместе с тем большое значение продолжают сохранять некоторые группы известных ранее лекарственных средств, в частности таких, структурную основу которых составляет бензольное ядро.
Сам бензол может быть причиной острых и хронических отравлений. Он оказывает раздражающее действие на кожу, пары его в большой концентрации вызывают возбуждение, расстройство дыхания. Монофункциональные производные бензола в большинстве случаев также обладают выраженными токсическими свойствами. Фенол, анилин, галогенопроизводные ароматического ряда служат исходными или промежуточными продуктами крупнотоннажной химической промышленности. В связи с этим необходимо учитывать их токсическое действие.
Среди монофункциональных производных бензола особое место занимает производное с карбоксильной группой — бензойная кислота, применяемая в медицине в виде натриевой соли (натрия бензоат) как отхаркивающее средство.
Бензойная кислота в свободном виде встречается в некоторых смолах и бальзамах, а также клюкве, бруснике, но чаще содержится в связанном виде, например, в виде N-бензоильного производного аминоуксусной кислоты C6H5CONHCH2COOH, называемого гиппуровой кислотой. Гиппуровая кислота образуется в печени из бензойной и аминоуксусной кислот и выводится с мочой. В клинической практике по количеству гиппуровой кислоты в моче больных (после приема бензоата натрия) судят об эффективности обезвреживающей функции печени.
Как гетерофункциональное соединение п- аминофенол образует производные по каждой функциональной группе в отдельности и одновременно по двум функциональным группам. п-Аминофенол ядовит. Интерес для медицины представляют его производные – парацетамол, фенацетин, оказывающие анальгетическое (обезболивающее) и жаропонижающее действие.
Парацетамол является N-ацетильным производным п-аминофенола. Фенацетин получается при ацетилировании этилового эфира п-аминофенола, называемого фенетидином.
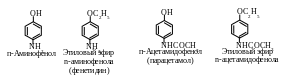
п-Аминобензойная кислота (ПАБК) и ее производные.
Эфиры ароматических аминокислот обладают общим свойством – способностью в той или иной степени вызывать местную анестезию, т.е. потерю чувствительности. Особенно заметно это свойство выражено у пара- производных. В медицине используют анестезин (этиловый эфир ПАБК) и новокаин (-диэтиламиноэтиловый эфир ПАБК). Новокаин применяют в виде соли (гидрохлорида), что связано с необходимостью повышения его растворимости в воде.
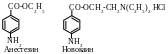
Анестезин и новокаин несколько уступают по силе анестезирующего действия кокаину, широко употреблявшемуся ранее в медицинской практике. Однако замена кокаина на новокаин имела важное значение в связи с выведением из практики вещества, при хроническом применении которого развивается лекарственная зависимость (кокаинизм). Новокаин в основе своей структуры имеет те же фрагменты, что и кокаин.
п-Аминобензойная кислота является фактором роста микроорганизмов и участвует в синтезе фолиевой кислоты, при недостатке или отсутствии которой микроорганизмы погибают. Название кислоты связано с выделением ее из листьев шпината (от лат. folium – лист). Фолиевая кислота играет важную роль в метаболизме нуклеиновых кислот и белков; в организме человека не синтезируется.
Фолиевая кислота (витамин В) включает три структурных фрагмента — ядро птеридина, п-аминобензойную и L-глутаминовую кислоты. Обе функциональные группы п- аминобензойной кислоты участвуют в образовании связей с двумя другими компонентами.
Сульфаниловая кислота (п-аминобензолсульфокислота) легко получается при сульфировании анилина, существует в виде диполярного иона. Амид сульфаниловой кислоты (сульфаниламид), известный под названием стрептоцид, является родоначальником группы лекарственных средств, обладающих антибактериальной активностью и называемых сульфаниламидами (сульфамидами).
Антибактериальное действие сульфаниламидов основано на том, что они являются антиметаболитами по отношению к п-аминобензойной кислоте, участвующей в биосинтезе фолиевой кислоты в микроорганизмах. Амид сульфаниловой кислоты имеет структурное сходство с п-аминобензойной кислотой. При наличии в бактериальной среде сульфаниламидов, они конкурируют с аминобензойной кислотой на стадии образования птероевой кислоты и связываются с птеридиновым фрагментом. Наличие сульфамидной группы препятствует дальнейшему взаимодействию с глутаминовой кислотой, и биосинтез фолиевой кислоты прекращается, что ведет к гибели бактерий. Избирательность бактериального действия сульфаниламидов основана на том, что фолиевая кислота в человеческом организме не синтезируется. Таким образом, сульфаниламиды блокируют метаболические реакции, существенные для определенных бактерий (пневмококки, стрептококки и др.), и в то же время не влияют на организм человека.
Салициловая кислота относится к группе гидроксибензойных кислот. Как о-гидроксибензойная кислота она легко декарбоксилируется при нагревании с образованием фенола.
Салициловая кислота растворима в воде, дает интенсивное окрашивание с хлоридом железа(III) (качественное обнаружение фенольной гидроксильной группы). Она оказывает антиспазматическое, жаропонижающее и антигрибковое действие, но как сильная кислота (рКа 2,98) вызывает раздражение пищеварительного тракта и поэтому применяется только наружно. Внутрь применяют ее производные – соли или эфиры. Салициловая кислота способна образовывать производные по любой функциональной группе. Практическое значение имеют салицилат натрия, сложные эфиры по СООН-группе (метилсалицилат, фенилсалицилат (салол)) и ОН-группе – ацетилсалициловая кислота (аспирин). Перечисленные производные (кроме салола) оказывают анальгетическое, жаропонижающее и противовоспалительное действие. Метилсалицилат из-за раздражающего действия используется наружно в составе мазей. Салол применяется как дезинфицирующее средство при кишечных заболеваниях и примечателен тем, что в кислой среде желудка не гидролизуется, а распадается только в кишечнике, поэтому используется также в качестве материала для защитных оболочек некоторых лекарственных средств, которые не стабильны в кислой среде желудка.
Салициловая кислота впервые была получена путем окисления салицилового альдегида, содержащегося в растении таволге (род Spireae). Отсюда и ее первоначальное название — спировая кислота, с которым связано название аспирин (начальная буква «а» обозначает ацетил). Ацетилсалициловая кислота в природе не найдена.
Из других производных салициловой кислоты большое значение имеет п- аминосалициловая кислота (ПАСК) как противотуберкулезное средство. ПАСК является антагонистом п-аминобензойной кислоты, необходимой для нормальной жизнедеятельности микроорганизмов. Другие изомеры таким действием не обладают. м-Аминосалициловая кислота является высокотоксичным веществом.
Контрольные задания
1. -Гидроксикислоты получают при действии водным раствором щелочи на - галогенокарбоновые кислоты. Синтезируйте молочную (2-гидроксипропановую) кислоту из соответствующей галогенкарбоновой кислоты. Каков механизм реакции? Является ли молочная кислота оптически активным соединением? Если да, изобразите оба энантиомера.
2. В метаболизме некоторых -аминокислот участвует гомосерин (2-амино-4- гидроксибутановая кислота) и его лактон. Напишите уравнение образования лактона гомосерина.
3. Яблочная кислота НООС-СНОН-СН2СООН при нагревании отщепляет воду. Напишите схему реакции дегидратации яблочной кислоты и объясните механизм. Чем объясняется легкость дегидратации яблочной кислоты?
4. Какое вещество можно распознать при помощи свежеосажденного гидроксида меди (II): а) глицерин; б) 1,3- бутадиен; в) этиловый спирт; г) бромбутан? К какому классу органических соединений относится выбранное Вами вещество? Обладает ли оно кислотными свойствами?
5. Наличие какой функциональной группы (групп) в молекуле салициловой кислоты подтверждает реакция декарбоксилирования:
а) карбоксильной; б) фенольного фрагмента; в) карбонильной; г) метильной; д) альдегидной.
6. Образование цикла при нагревании 4-гидроксипентановой кислоты это реакция:
а) дегидрирование; б) дегидратация; в) гидролиз; г) гидрирование; д) гидратация.
Приведите формулу соединения, образующегося при нагревании 4-гидроксипентановой кислоты.
