
- •Введение. Роль, задачи и предмет дисциплины «Теоретические основы химической технологии органических веществ».
- •Химико-технологический процесс, его стадии.
- •Классификация химических реакций.
- •Этапы разработки химико-технологического процесса.
- •Стехиометрическая матрица и определение числа стехиометрически независимых превращений. Ключевые вещества.
- •Парциальные молярные материальные балансы. Показатели химико-технологических процессов. Парциальные молярные балансы
- •Показатели химико-технологического процесса и показатели химического производства
- •Производительность, расходный коэффициент, степень конверсии реагента, селективность реакции, выход продукта.
- •Расчет молярного материального баланса в случае реакций, протекающих без изменения и с изменением объема реакционной системы.
- •Растворители, применяемые в химической технологии органических веществ и их классификация.
- •Расчет молярных материальных балансов в случае газофазных реакций. Закон Дальтона.
- •Законы термодинамики.
- •Равновесие химических реакций.
- •Законы Вант-Гоффа, Кирхгофа.
- •Метод Темкина-Шварцмана.
- •Равновесие в случае идеальных и реальных газов, расчет константы равновесия.
- •Алгоритм нахождения константы равновесия Kp для реальной газовой смеси:
- •Расчет состава реакционной смеси в случае последовательных реакций.
- •Расчет состава реакционной смеси в случае параллельных реакций.
- •Фугитивность (летучесть), принцип соответственных состояний.
- •Равновесие в случае идеальных и реальных жидкостей, расчет константы равновесия. Расчет констант равновесия в идеальных растворах.
- •Соотношение между kp и kn.
- •Расчет равновесий для систем, отклоняющихся от законов Рауля и Генри (для неидеальных растворов).
- •Законы Рауля и Генри.
- •Теоретические и экспериментальные методы определения константы равновесия.
- •Экспериментальное определение констант равновесия.
- •Экспериментальное определение термодинамических параметров с использованием константы равновесия при различных температурах
- •Экспериментальное определение константы равновесия для различных температур.
- •Приведение констант к общим единицам измерения
- •Использование термодинамических параметров для обоснования выбора условий проведения процесса химической технологии органических веществ.
- •Кинетический подход к описанию реакций. Механизм реакции и этапы его установления. Лимитирующая стадия сложной реакции.
- •Скорость реакции и константа скорости реакции, их размерности. Графическое отображение скорости реакции.
- •Закон действующих масс. Кинетические модели и кинетические кривые.
- •Преобразование кинетических уравнений с учетом разных форм состояний реагентов и катализаторов.
- •Методы подтверждения механизмов химических реакций. Прямые и косвенные методы.
- •1. Использование кинетических изотопных эффектов.
- •3. Изучение цис-, транс- изомеров.
- •Применение физико-химических и химических методов для установления структуры органических соединений (реагентов, продуктов и промежуточных веществ).
- •Гомогенный катализ, сущность действия гомогенных катализаторов, энергетическая диаграмма гомогенного катализа.
- •Механизм и элементарные стадии гомогенного катализа. Комплексы Аррениуса и Вант-Гоффа. Кинетика гомогенного катализа
- •Классификация гомогенных катализаторов. Кислотно-основные катализаторы и принцип их действия.
- •Кислотно – основной катализ;
- •Кислотно – основной катализ
- •Свойства катализаторов
- •Неизменность состава, количества и структуры катализатора.
- •2. Специфичность катализатора.
- •Нуклеофильный катализ в процессах химической технологии органических веществ. Кинетическая модель нуклеофильного катализа в процессах химической технологии органических веществ.
- •Влияние растворителя на нуклеофильный катализ
- •Иммобилизация и иммобилизованные катализаторы. Катиониты и аниониты.
Расчет равновесий для систем, отклоняющихся от законов Рауля и Генри (для неидеальных растворов).
Таких систем большинство и для них необходимо знать термодинамические параметры всех компонентов в стандартном состоянии. За стандартное состояние растворителя принимается стандартное состояние чистого растворителя (при стандартных условиях). За стандартное состояние растворенного вещества принимается фиктивное или гипотетическое состояние в идеальном растворе, когда активность этого вещества равна 1, но с теми же термодинамическими параметрами, которыми вещество обладает в бесконечно разбавленном растворе.
В реальных растворах активность соответствует мольной доле только при бесконечном разбавлении:
![]()
Ki – константа распределения (константа фазового равновесия для i-го компонента).
![]()
Для определения Ki проводят экспериментальные исследования в области очень разбавленных растворов, постепенно снижая концентрацию раствора Ni.

Эта зависимость будет прямой линией только при концентрациях близких к 0.
Из найденного графически значения Ki рассчитывают парциальные давления пара i-ого компонента над раствором, где его активность равна 1.
![]()
![]()
![]()
![]()
![]()
Если
в реакции имеются твердые компоненты,
то принимают, что их активность равна
1 и
![]() равна 0, поэтому их не учитывают. Для
растворителя необходимо учитывать
поправку, которая учитывает, что
активность растворителя равна отношению
парциального давления пара над данным
раствором и над чистой жидкостью.
равна 0, поэтому их не учитывают. Для
растворителя необходимо учитывать
поправку, которая учитывает, что
активность растворителя равна отношению
парциального давления пара над данным
раствором и над чистой жидкостью.
![]()
Законы Рауля и Генри.
Закон Рауля:
 ,
,
где ― давление насыщенного пара растворителя над чистым растворителем;
― давление насыщенного пара растворителя над раствором;
Ni ― мольная доля растворенного вещества в растворе (его растворимость).
![]()
![]()
![]()
Закон Генри:
![]() ,
,
где K – постоянная Генри.
В идеальных растворах К= (в-ва) , т.к.
Теоретические и экспериментальные методы определения константы равновесия.
1 способ основан на использовании справочной литературы, поскольку:
,
.
Для жидкостей считают, что
![]() .
.
2 способ ― расчетный ― используется при отсутствии справочных данных:
![]()
где
![]() ―
энергия Гиббса
образования i-го
компонента в стандартном состоянии в
виде чистой жидкости;
―
энергия Гиббса
образования i-го
компонента в стандартном состоянии в
виде чистой жидкости;
![]() ―
энергия
Гиббса образования i-го
компонента в стандартном состоянии в
газовой фазе;
―
энергия
Гиббса образования i-го
компонента в стандартном состоянии в
газовой фазе;
![]() ―
энергия
Гиббса перевода i-го
компонента из состояния насыщенного
пара в стандартное газовое состояние;
―
энергия
Гиббса перевода i-го
компонента из состояния насыщенного
пара в стандартное газовое состояние;
![]() ―
энергия
Гиббса перевода i-го
компонента из стандартного жидкого
состояния в стандартное газовое (процесс
испарения).
―
энергия
Гиббса перевода i-го
компонента из стандартного жидкого
состояния в стандартное газовое (процесс
испарения).
≈ 0, т.к. испарение не сопровождается изменением энергии Гиббса.
![]() где
где
![]() ― давление
насыщенного пара чистой жидкости i-го
компонента.
― давление
насыщенного пара чистой жидкости i-го
компонента.
Поэтому выражение упрощается:
![]()
Определив
для всех участников значения
,находят
![]() (
(![]() ),
затем из уравнения
изотермы Вант-Гоффа
),
затем из уравнения
изотермы Вант-Гоффа
![]() определяют
Ка
= КN
.
определяют
Ка
= КN
.
Этот метод справедлив только тогда, когда
Ка = КN ≠ f (состава смеси).
Экспериментальное определение констант равновесия.
Статические методые. Реакцию проводят в периодическом реакторе
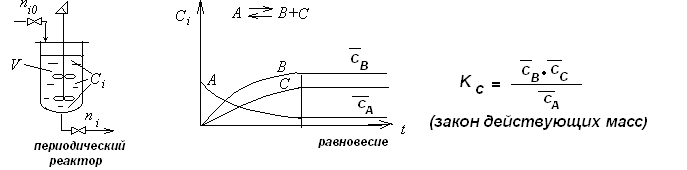
В динамических методах используется непрерывный реактор вытеснения.
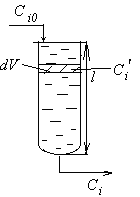
Процесс ведут так, что постепенно увеличивают время пребывания реакционной смеси в аппарате до тех пор, пока на выходе не будет достигнут приблизительно постоянный состав, который будет соответствовать равновесию.
