
- •Введение. Роль, задачи и предмет дисциплины «Теоретические основы химической технологии органических веществ».
- •Химико-технологический процесс, его стадии.
- •Классификация химических реакций.
- •Этапы разработки химико-технологического процесса.
- •Стехиометрическая матрица и определение числа стехиометрически независимых превращений. Ключевые вещества.
- •Парциальные молярные материальные балансы. Показатели химико-технологических процессов. Парциальные молярные балансы
- •Показатели химико-технологического процесса и показатели химического производства
- •Производительность, расходный коэффициент, степень конверсии реагента, селективность реакции, выход продукта.
- •Расчет молярного материального баланса в случае реакций, протекающих без изменения и с изменением объема реакционной системы.
- •Растворители, применяемые в химической технологии органических веществ и их классификация.
- •Расчет молярных материальных балансов в случае газофазных реакций. Закон Дальтона.
- •Законы термодинамики.
- •Равновесие химических реакций.
- •Законы Вант-Гоффа, Кирхгофа.
- •Метод Темкина-Шварцмана.
- •Равновесие в случае идеальных и реальных газов, расчет константы равновесия.
- •Алгоритм нахождения константы равновесия Kp для реальной газовой смеси:
- •Расчет состава реакционной смеси в случае последовательных реакций.
- •Расчет состава реакционной смеси в случае параллельных реакций.
- •Фугитивность (летучесть), принцип соответственных состояний.
- •Равновесие в случае идеальных и реальных жидкостей, расчет константы равновесия. Расчет констант равновесия в идеальных растворах.
- •Соотношение между kp и kn.
- •Расчет равновесий для систем, отклоняющихся от законов Рауля и Генри (для неидеальных растворов).
- •Законы Рауля и Генри.
- •Теоретические и экспериментальные методы определения константы равновесия.
- •Экспериментальное определение констант равновесия.
- •Экспериментальное определение термодинамических параметров с использованием константы равновесия при различных температурах
- •Экспериментальное определение константы равновесия для различных температур.
- •Приведение констант к общим единицам измерения
- •Использование термодинамических параметров для обоснования выбора условий проведения процесса химической технологии органических веществ.
- •Кинетический подход к описанию реакций. Механизм реакции и этапы его установления. Лимитирующая стадия сложной реакции.
- •Скорость реакции и константа скорости реакции, их размерности. Графическое отображение скорости реакции.
- •Закон действующих масс. Кинетические модели и кинетические кривые.
- •Преобразование кинетических уравнений с учетом разных форм состояний реагентов и катализаторов.
- •Методы подтверждения механизмов химических реакций. Прямые и косвенные методы.
- •1. Использование кинетических изотопных эффектов.
- •3. Изучение цис-, транс- изомеров.
- •Применение физико-химических и химических методов для установления структуры органических соединений (реагентов, продуктов и промежуточных веществ).
- •Гомогенный катализ, сущность действия гомогенных катализаторов, энергетическая диаграмма гомогенного катализа.
- •Механизм и элементарные стадии гомогенного катализа. Комплексы Аррениуса и Вант-Гоффа. Кинетика гомогенного катализа
- •Классификация гомогенных катализаторов. Кислотно-основные катализаторы и принцип их действия.
- •Кислотно – основной катализ;
- •Кислотно – основной катализ
- •Свойства катализаторов
- •Неизменность состава, количества и структуры катализатора.
- •2. Специфичность катализатора.
- •Нуклеофильный катализ в процессах химической технологии органических веществ. Кинетическая модель нуклеофильного катализа в процессах химической технологии органических веществ.
- •Влияние растворителя на нуклеофильный катализ
- •Иммобилизация и иммобилизованные катализаторы. Катиониты и аниониты.
Производительность, расходный коэффициент, степень конверсии реагента, селективность реакции, выход продукта.
Производительность – количество получаемого или перерабатываемого продукта (в тоннах, килограммах, миллионы тонн) в единицу времени (в часах, сутках или годах).
При расчетах производительности за длительный срок, принимают, что 1 год = 80000 часов = 330 суток. Например, для установок первичной переработки нефти производительность составляет 2 млн. т. в год.
![]()
Расходный коэффициент – количество сырья, материалов и энергии, необходимое для получения единицы продукции. Расходные коэффициенты отражают затратную сторону производства, однако эффективность не показывает.
![]()
![]()
Критериями эффективность, в которых наиболее полно отражается сущность химических и физико-химических процессов в реакторе, являются селективность, конверсия и выход.
Степенью конверсии реагента А, называют долю прореагировавшего реагента А относительно его начального количества. Исходя из определения:
![]()
![]() .
.
Для всех других реагентов, аналогично степень конверсии записывается:
![]()
![]()
![]()
Так как, уравнение материального баланса имеет вид:
![]()
То:
![]()
![]()
![]()
![]()
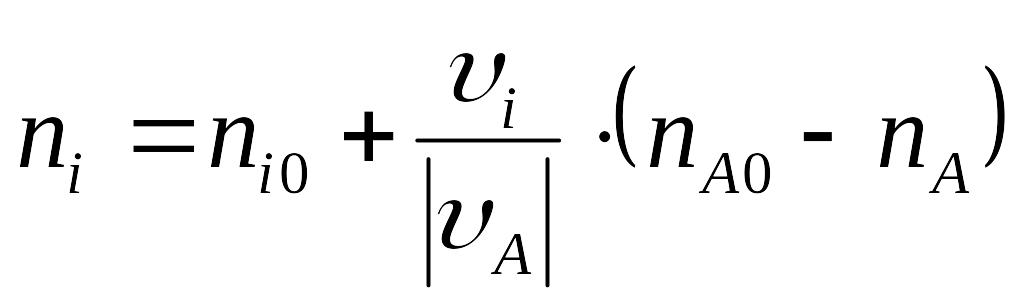
Таким образом, уравнение материального баланса через степень конверсии имеет вид:
![]()
Для непрерывного процесса:
![]()
Низкая степень конверсии не отражает эффективности процесса, а лишь только дают долю превращенного реагента.
Например:
2А + 3Y ↔ B + 2Z
Найти текущие количества вещества nA, nY, nB, nZ.
![]()
![]()
Или:
![]()
Аналогично:
![]()
![]()
Степень конверсии ограничивается:
Установлением равновесия в системе.
Длительностью реакции.
Возможностью за определенное время реакции подвода и отвода необходимого количества тепла.
Селективность (реакции) – отношение количества полученного продукта к его теоретическому количеству, которое могло бы получиться из реагента А в отсутствии побочных реакций. Таким образом, селективность можно определять только для сложных реакций! Для простых реакций понятие не имеет смысла!
![]()
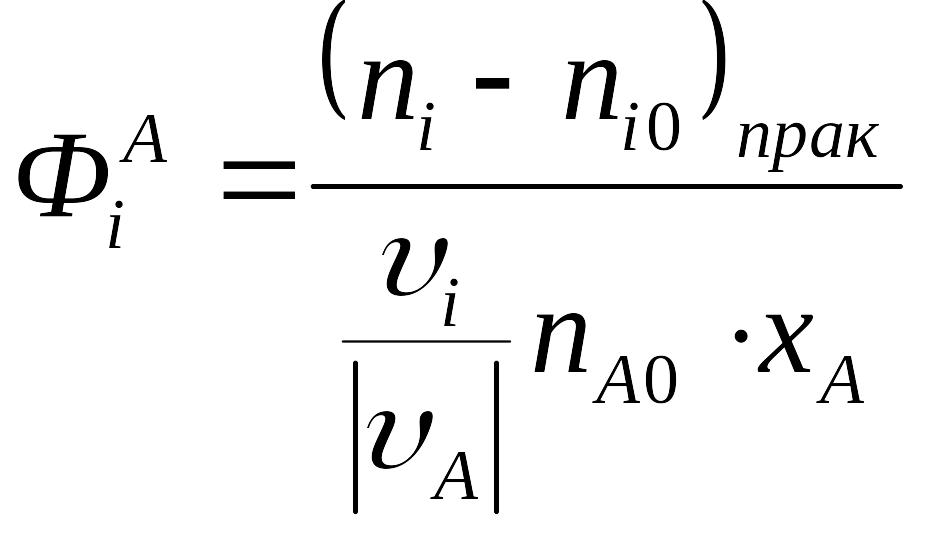
Для непрерывных процессов:
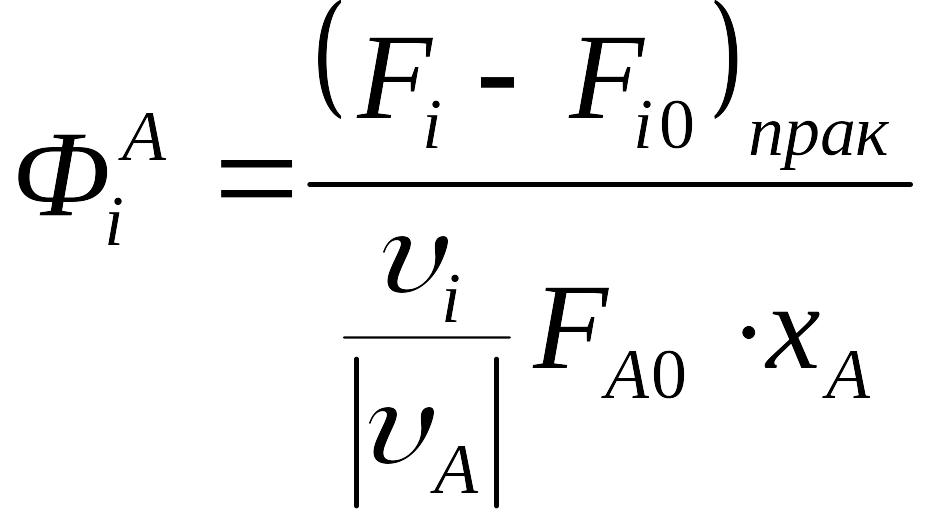
Если весь реагент превратился в продукт, то селективность равна 1. Но, как правило, селективность не равна 1, то она может изменяться в пределах 0,5-0,6…1. Селективность характеризует эффективность процесса с точки зрения использованного сырья на взятое сырье.
Выход целевого продукта – отношение реально полученного продукта к максимально возможному, которое может получиться теоретически в данном реакторе в данных условиях. Показатель, наиболее полно характеризующий эффективность процесса.
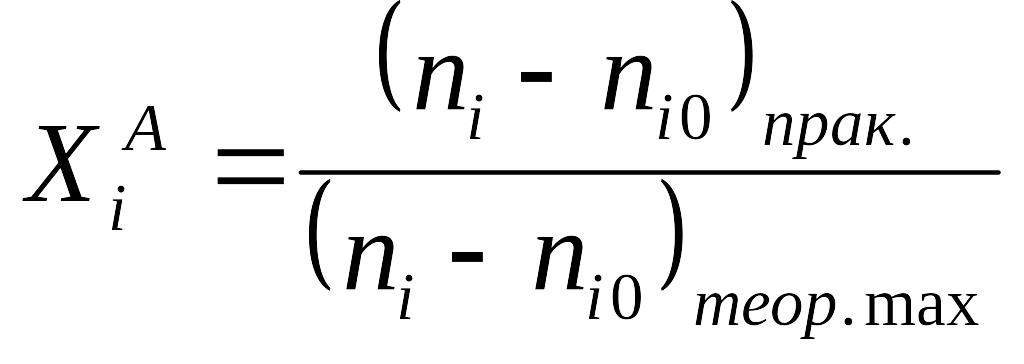
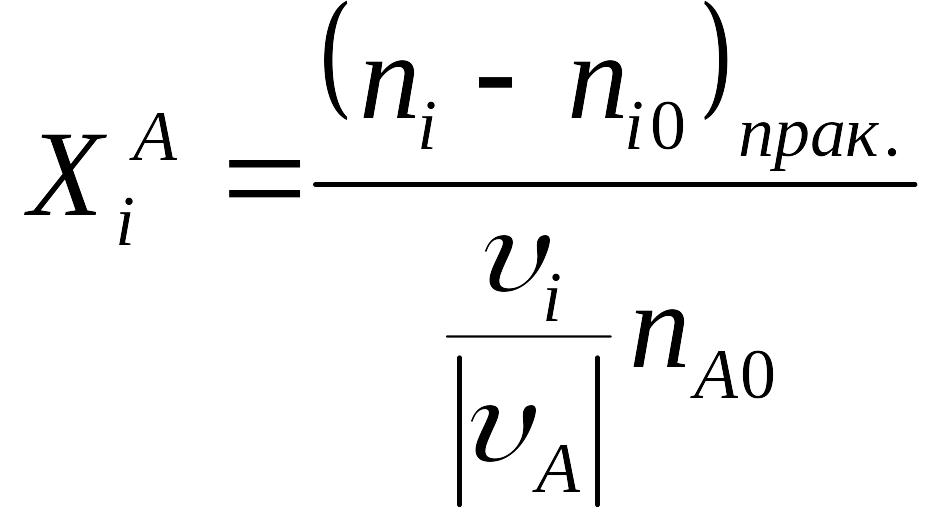
Расчет молярного материального баланса в случае реакций, протекающих без изменения и с изменением объема реакционной системы.
Растворители, применяемые в химической технологии органических веществ и их классификация.
Классификация растворителей
Наиболее употребительна химическая классификация растворителей, основанная на их природе, в соответствии с которой они подразделяются на неорганические и органические. Самым распространённым неорганическим растворителем, применяемым для большого числа неорганических и органических соединений, является вода.
Другой общий принцип классификации растворителей - их фазовое состояние. В соответствии с ним различают жидкие и твердые растворители (парафин для углеводородов, металлы для неметаллов).
Неорганические растворители
К числу неорганических растворителей относятся: жидкий аммиак — хороший растворитель для щелочных металлов, производные фосфора, серы, солей, аминов и др. веществ; жидкий сернистый ангидрид — растворитель для многих органических и неорганических соединений, используемый, в частности, в промышленности для очистки нефтепродуктов; расплавленные металлы (ртуть, галлий) и соли и т.д..
Органические растворители Большое значение имеют многочисленные органические растворители. Это, прежде всего, углеводороды и их галогенопроизводные, спирты, простые и сложные эфиры, кетоны, нитросоединения. Органические растворители очень широко применяются в производстве пластмасс, лаков и красок, синтетических волокон, смол, клеев, в полиграфии, резиновой промышленности, при экстракции растительных жиров, для химической чистки одежды; кроме того, их используют для очистки химических соединений перекристаллизацией, при хроматографическом разделении веществ, для создания определённой среды и т. д.
Можно выделить группы растворителей в зависимости от других характеристик: температуры кипения — низкокипящие растворители (например, этиловый спирт, метилацетат) и высококипящие растворители (например, ксилол); относительной скорости испарения — быстроиспаряющиеся и медленноиспаряющиеся (в качестве эталона часто берут скорость испарения бутилацетата); полярности — неполярные (углеводороды, сероуглерод) и полярные (например, вода, спирты, ацетон); токсичности. Технические условия на растворителе обычно содержат данные по температуре вспышки, по пределам взрывоопасных концентраций паров в воздухе, по давлению пара при стандартных температурах, а также по растворяющей способности — для какого типа веществ можно использовать данный растворители (для растворения масел и жиров, смол, красителей, каучуков натуральных и синтетических и т. п.).
В качестве растворителей используются смеси различных индивидуальных веществ, например бензины, петролейный эфир, смеси спиртов и эфиров. К числу растворителей часто относят также пластификаторы, служащие для улучшения механических и физических свойств каучуков, природных смол, полиамидов и многих других высокомолекулярных соединений.
