
- •Введение. Роль, задачи и предмет дисциплины «Теоретические основы химической технологии органических веществ».
- •Химико-технологический процесс, его стадии.
- •Классификация химических реакций.
- •Этапы разработки химико-технологического процесса.
- •Стехиометрическая матрица и определение числа стехиометрически независимых превращений. Ключевые вещества.
- •Парциальные молярные материальные балансы. Показатели химико-технологических процессов. Парциальные молярные балансы
- •Показатели химико-технологического процесса и показатели химического производства
- •Производительность, расходный коэффициент, степень конверсии реагента, селективность реакции, выход продукта.
- •Расчет молярного материального баланса в случае реакций, протекающих без изменения и с изменением объема реакционной системы.
- •Растворители, применяемые в химической технологии органических веществ и их классификация.
- •Расчет молярных материальных балансов в случае газофазных реакций. Закон Дальтона.
- •Законы термодинамики.
- •Равновесие химических реакций.
- •Законы Вант-Гоффа, Кирхгофа.
- •Метод Темкина-Шварцмана.
- •Равновесие в случае идеальных и реальных газов, расчет константы равновесия.
- •Алгоритм нахождения константы равновесия Kp для реальной газовой смеси:
- •Расчет состава реакционной смеси в случае последовательных реакций.
- •Расчет состава реакционной смеси в случае параллельных реакций.
- •Фугитивность (летучесть), принцип соответственных состояний.
- •Равновесие в случае идеальных и реальных жидкостей, расчет константы равновесия. Расчет констант равновесия в идеальных растворах.
- •Соотношение между kp и kn.
- •Расчет равновесий для систем, отклоняющихся от законов Рауля и Генри (для неидеальных растворов).
- •Законы Рауля и Генри.
- •Теоретические и экспериментальные методы определения константы равновесия.
- •Экспериментальное определение констант равновесия.
- •Экспериментальное определение термодинамических параметров с использованием константы равновесия при различных температурах
- •Экспериментальное определение константы равновесия для различных температур.
- •Приведение констант к общим единицам измерения
- •Использование термодинамических параметров для обоснования выбора условий проведения процесса химической технологии органических веществ.
- •Кинетический подход к описанию реакций. Механизм реакции и этапы его установления. Лимитирующая стадия сложной реакции.
- •Скорость реакции и константа скорости реакции, их размерности. Графическое отображение скорости реакции.
- •Закон действующих масс. Кинетические модели и кинетические кривые.
- •Преобразование кинетических уравнений с учетом разных форм состояний реагентов и катализаторов.
- •Методы подтверждения механизмов химических реакций. Прямые и косвенные методы.
- •1. Использование кинетических изотопных эффектов.
- •3. Изучение цис-, транс- изомеров.
- •Применение физико-химических и химических методов для установления структуры органических соединений (реагентов, продуктов и промежуточных веществ).
- •Гомогенный катализ, сущность действия гомогенных катализаторов, энергетическая диаграмма гомогенного катализа.
- •Механизм и элементарные стадии гомогенного катализа. Комплексы Аррениуса и Вант-Гоффа. Кинетика гомогенного катализа
- •Классификация гомогенных катализаторов. Кислотно-основные катализаторы и принцип их действия.
- •Кислотно – основной катализ;
- •Кислотно – основной катализ
- •Свойства катализаторов
- •Неизменность состава, количества и структуры катализатора.
- •2. Специфичность катализатора.
- •Нуклеофильный катализ в процессах химической технологии органических веществ. Кинетическая модель нуклеофильного катализа в процессах химической технологии органических веществ.
- •Влияние растворителя на нуклеофильный катализ
- •Иммобилизация и иммобилизованные катализаторы. Катиониты и аниониты.
Свойства катализаторов
Неизменность состава, количества и структуры катализатора.
2. Специфичность катализатора.
Например, катализаторы кислой природы активны в отношении большого числа реакций изомеризации, гидролиза, дегидратации спиртов, алкилирования и многих других; катализаторы на основе переходных металлов (Pt, Cu, Ni, Fe) ускоряют гидрирования и т.д.
3. Селективность катализатора. Это способность ускорять одну из возможных при данных условиях параллельных реакций.
Например:

или

Катализатор не изменяет величину константы равновесия для обратимых реакций: только ускорение достижения равновесия.
Нуклеофильный катализ в процессах химической технологии органических веществ. Кинетическая модель нуклеофильного катализа в процессах химической технологии органических веществ.
Для органических реакций важное значение имеют нуклеофильные катализаторы.
Наиболее распространены:
ионы галогенов I-, Cl-, F-;
оксианионы AlKO-, ArO-, HCO3-, CO32-, PO4-;
амины R3N, R2NH, RNH2, C5H5N;
другие анионы NO2-, CN- и другие.
Нуклеофильные реакции бывают присоединения и замещения.
X=Z + YH → Y–X–Z–H
Первый механизм:
X=Z + Y- → Y–X–Z-;
Y–X–Z- + HY → Y–X–Z–H + Y-. лимитирующая стадия
Второй механизм:
X=Z + YH ↔ X=Z…HY → Y–X–Z–H
Обратимые реакции не лимитируют.
![]() быстрая
стадия;
быстрая
стадия;
![]() лимитирующая
стадия.
лимитирующая
стадия.
![]()
![]()
![]()
![]() .
.
Катализатор присутствует в двух формах RNu и Nu, следовательно, баланс по катализатору запишется в следующем виде:
![]()
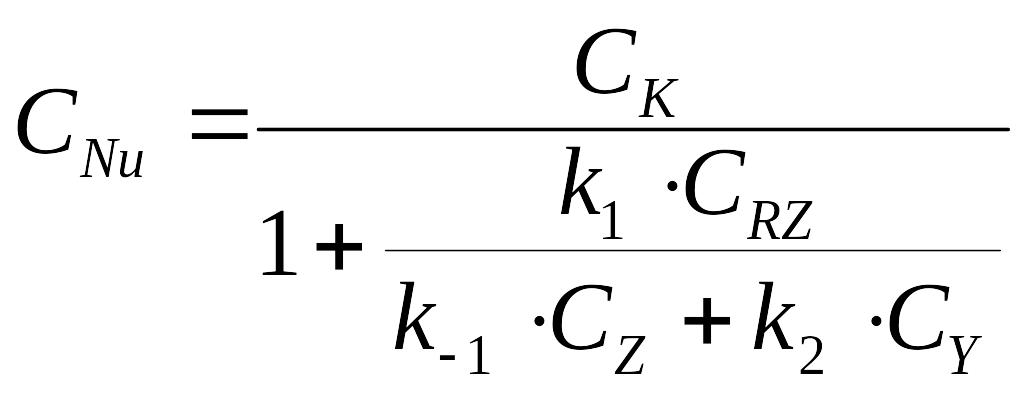
![]()
Влияние растворителя на нуклеофильный катализ
Полярные апротонные растворители (диметилформамид, ацетонитрил, диметилсульфооксид) увеличивают скорость нуклеофильного катализа, так как нуклеофильный катализатор R+Nu- в этих растворителях диссоциирует:
R+Nu- ↔ Nu- + R+.
Образующийся анион в реакцию с растворителем не вступает.
В протонных растворителях (H2О, метанол, этанол) нуклеофильная активность катализатора уменьшается в 102 – 105 раз за счет образования водородных связей.
Нуклеофил окружает себя молекулами растворителя за счет электростатических сил:
[Nu-…(HOR)n].
Металлокомплексный катализ в процессах химической технологии органических веществ. Кинетическая модель металлокомплексного катализа в процессах химической технологии органических веществ. Функция закомплексованности.
Катализ органических реакций комплексами металлов в настоящее время является интенсивно развивающейся областью гомогенного катализа. В присутствии этих катализаторов реакция характеризуется очень высокой скоростью и селективностью. Обычно комплексы образуют переходные металлы Fe, Co, Ni и другие.
Каталитические свойства металлокомплексов обеспечиваются наличием у соответствующих металлов близких по энергии орбиталей:
ns1 np3 nd5,
где n – номер периода переходного металла.
Эти 9 валентных орбиталей могут образовывать связи практически с каждым атомом или группой атомов.
Иммобилизация и иммобилизованные катализаторы. Катиониты и аниониты.
Многие гомогенные катализаторы стараются перевести в гетерогенное состояние.
Катиониты
В зависимости от силы ионогенной группы различаются сильно-, средне- и слабокислотные катиониты,
которые могут работать в различных условиях .
Сильнокислотные сульфокатиониты сорбируют все катионы металлов из раствора, поэтому их называют
универсальными – марка КУ. Они работают при рН раствора от 0 до 14, но наиболее эффективны при рН
раствора от 2 до 14.
Соответственно с рядом селективности для вытеснения из катионита сорбированных катионов из правой
части ряда, т.е. для их регенерации, необходимо использовать только достаточно концентрированные
растворы либо кислот, либо солей натрия и калия, взятых с большим избытком по сравнению со
стехиометрическим количеством.
К сульфокислотным катионитам относится и сульфоуголь, представляющий собой продукт обработки
дробленых частиц угля концентрированной серной кислотой. Поскольку сульфированию подвергаются разные
органические группы, составляющие каркас угля, он имеет свойства сильно- и среднекислотного катионита.
Сульфоуголь – это первый промышленный катионит. По сравнению с современными синтетическими
катионитами он обладает низкими емкостью (порядка 500–700 мг-экв/л), прочностью и требует больших
расходов регенерационных агентов и промывной воды. Единственное его достоинство – низкая цена, за
которую расплачиваются большими эксплуатационными расходами. Выпускается только в РФ и КНР.
Среднекислотные фосфорнокислотные катиониты обладают селективностью к ионам водорода и
поливалентных металлов. Могут использоваться для очистки разбавленных и концентрированных растворов
от поливалентных металлов. Их емкость и ряд селективности сильно зависят от рН раствора. Легко
регенерируются слабыми растворами кислот. В водоподготовке не применяются.
Слабокислотные карбоксильные катиониты обладают высокой селективностью к ионам водорода и
поливалентных металлов. Ряд селективности зависит от рН и по сравнению с сильнокислотными катионитами
имеет обращенный вид.
Ион водорода легко вытесняет все другие катионы, и такие иониты могут эффективно работать только в
щелочной среде при рН раствора от 7 до 14. Они могут регенерироваться практически стехиометрическим количеством кислоты.
Используются для умягчения воды со снижением ее щелочности, а также для извлечения тяжелых металлов.
Аниониты
В зависимости от силы ионогенной группы различаются сильно-, средне- и слабоосновные аниониты,
которые могут работать в различных условиях .
Сильноосновные аниониты сорбируют все анионы солей из раствора. Они работают при рН раствора от 0 до
14, но наиболее эффективны при рН раствора от 0 до 10.
Соответственно они могут регенерироваться только достаточно концентрированными растворами щелочей
либо растворимых фторидов, карбонатов или хлоридов, взятых с большим избытком по сравнению со
стехиометрическим количеством.
Используются в основном для доочистки воды от анионов слабых кислот. При работе в Cl -форме могут
поглощать из воды такие анионы, как NO3 –, SO4 2–.
Необратимо поглощают природные органические кислоты, что постепенно существенно снижает их рабочую
емкость.
Среднеосновные аниониты как правило бифункциональны. Поэтому они сорбируют в основном анионы
сильных кислот, но в незначительных количествах могут поглощать и анионы слабых кислот. Обладают
большей, чем сильноосновные, обменной емкостью. В определенных условиях обладают селективностью к
ионам поливалентных металлов. Их емкость и ряд селективности сильно зависят от рН раствора.
Имеют высокое сродство к гидроксил-ионам. Поэтому могут регенерироваться разбавленными растворами
щелочей, взятых с небольшим избытком по сравнению со стехиометрическим количеством.
Используются совместно с катионитом для обессоливания воды.
Слабоосновные аниониты сорбируют анионы только сильных кислот. Обладают значительно большей, чем
сильноосновные, обменной емкостью, но худшими кинетикой обмена, химической и механической
прочностью. Их емкость и ряд селективности сильно зависят от рН раствора.
Имеют высокое сродство к гидроксил-ионам. Поэтому могут извлекать анионы только из кислых сред и
регенерируются разбавленными растворами щелочей, взятых практически в стехиометрическом количестве.
Ряд таких смол, прежде всего на основе полиакрилатов, обладает способностью обратимо поглощать
природные органические кислоты, что дает возможность использовать их как органопоглотители
(скавенжеры).
Используются совместно с катионитом для обессоливания воды.
