
- •1. Методы анализа и их ошибки
- •1.1. Выбор метода анализа
- •1.2. Чувствительность методов анализа
- •1.3. Ошибки и их классификация
- •2.1. Электрохимические методы анализа
- •3. Кондуктометрия
- •Предельная эквивалентная электропроводность
- •3.2. Влияние различных факторов на электропроводность
- •3.2.1. Влияние природы электролита и растворителя
- •3.2.2. Влияние концентрации электролита
- •3.2.3. Влияние температуры
- •3.3. Методы кондуктометрического анализа
- •3.3.1. Прямая кондуктометрия
- •3.3.2.Кондуктометрическое титрование
- •3.3.2.1. Метод осаждения
- •3.3.2.2. Метод нейтрализации
- •II. Титрование слабой кислоты сильным основанием и наоборот.
- •3.3.2.3. Метод комплексонометрии
- •3.3.3. Измерение электропроводности растворов
- •3.4. Высокочастотное титрование
- •3.4.1. Теоретические основы и общие положения теории высокочастотного титрования
- •3.5. Потенциометрия
- •3.5.1. Классические электроды
- •3.5.2. Мембранные электроды
- •3.5.2.1. Электроды с твёрдой мембраной
- •3.5.2.2. Стеклянные электроды
- •3.5.2.3. Электроды с жесткими мембранами
- •I группа.
- •II группа:
- •3.5.3. Способы определения эдс
- •3.5.4. Методы потенциометрии
- •1) Прямая потенциометрия.
- •2) Метод добавок.
- •3.5.4.1. Метод осаждения.
- •3.5.4.2. Метод нейтрализации.
- •3.5.4.3. Окислительно-восстановительный метод
- •6. Сущность полярографического метода анализа
- •6.1. Основы метода.
- •6.2. Диффузный ток.
- •6.3. Уравнение Ильковича.
- •6.4. Полярографическая кривая
- •6.5. Капельный ртутный катод
- •6.6. Полярографический фон.
- •6.7. Область применения полярографического анализа
- •6.8 Методика полярографического анализа.
- •6.9. Полярографы.
3.3.2.3. Метод комплексонометрии
I. Комплексон не является кислотой, в процессе титрования не выделяется Н+, а образующийся комплекс представляет заряженную частицу.
В этом случае комплексон является либо неэлектролитом, либо слабым электролитом.
Пример: 18-краун-6 (рис. 13).
Рис. 13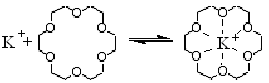
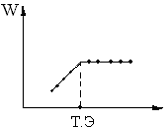
В результате комплексообразования до точки эквивалентности электропроводность раствора обычно возрастает из-за увеличения радиуса образующегося комплексного иона, что приводит к снижению степени его гидратации и увеличению подвижности.
После точки эквивалентности добавление слабого электролита не приводит к изменению W.
Пример: если добавляемый комплексон является громоздкой структурой, то образующееся комплексное соединение может обладать меньшей подвижностью, чем определяемый ион и поэтому до точки эквивалентности электропроводность раствора уменьшается, а после точки эквивалентности остаётся неизменной.
II. Комплексоны – слабые органические кислоты, в процессе титрования выделяют Н+, образующийся комплекс не заряжен.
Пример: a) титрование в водном растворе (рис. 14).
Ca2++Na2[H2ЭДТА] = Na2[Ca ЭДТА]+ 2H+ (1)
N
Рис. 14.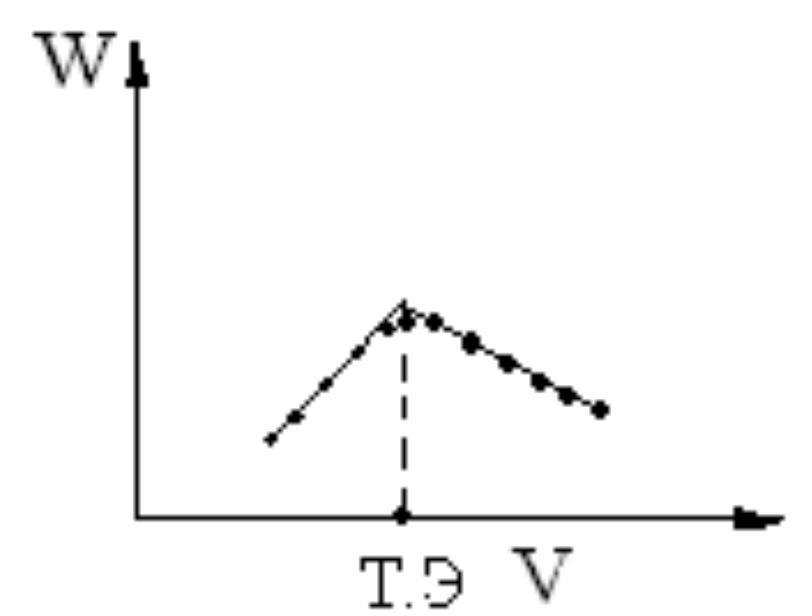
До точки эквивалентности электропроводность увеличивается W за счет появления вместо Ca2+ ( ½Ca =59,6) эквивалентного количества ионов Н+ (1), обладающих большей подвижностью ( H =349,8). После точки эквивалентности добавление избытка титранта – натриевой соли слабой кислоты приведет к образованию слабой кислоты (H4ЭДТА) в протонированном виде (2), вместо Н+ будет появляться эквивалентное количество Na+, обладающих меньшей подвижностью 0Na =50,1; и электропроводность будет уменьшаться W.
Титрование необходимо проводить без добавления больших количеств кислот или оснований.
Пример: б) титрование в буферном растворе: NH4OH-NH4Cl – аммиачный буфер (рис. 15).
Сa2+ + Na2[H2ЭДТА] = Na2[CaЭДТА] + 2H+ (I)
2H+ + 2NH4OH = 2H2O + 2NH4+ (II)
П
Рис. 15
![]() =73,6
=73,6
После точки эквивалентности при избытке титранта электропроводность раствора увеличивается более сильно.
Наличие в растворе буфера, один компонент которого является сильным электролитом, приводит к загрублению результатов анализа, поэтому буферные растворы следует использовать в невысоких концентрациях (0,05-0,1 моль/л).
3.3.3. Измерение электропроводности растворов
Электропроводность раствора определяют, измеряя активное сопротивление между погруженными в него электродами. Для измерения сопротивления пользуются переменным током звуковой частоты (1000 Гц), т. к. постоянный ток вызывает разложение раствора и поляризацию электродов.
Сопротивление раствора электролита определяют путем сравнения его сопротивления с эталонным сопротивлением. Для этого используют мостик Уитстона (рис. 16). Сопротивления R1, R2, R3, RX подбирают так, чтобы, ток в диагонали мостика отсутствовал, т. е. сопротивление его ветвей было пропорционально друг другу. Измеряемое сопротивление RX можно найти по формуле.
R
Рис. 16. Мостик
Уитстона:
1 - звуковой
генератор; 2
- индикатор
нуля; 3 -
электролитическая
ячейка. R1,
R2,
R3,
RX
- плечи мостика; C
- переменная
емкость.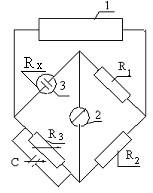
![]()
Сопротивления R1, и R2 выбирают постоянными или сохраняют постоянным их соотношение; R3 может изменяться. При балансировке моста регулируют сопротивление R3 и находят сопротивление RX.
Ошибки, связанные с поляризационными явлениями, уменьшаются с повышением частоты тока и увеличением концентрации. При частоте тока выше 1000 Гц влияние поляризации незначительно.
