
- •1. Методы анализа и их ошибки
- •1.1. Выбор метода анализа
- •1.2. Чувствительность методов анализа
- •1.3. Ошибки и их классификация
- •2.1. Электрохимические методы анализа
- •3. Кондуктометрия
- •Предельная эквивалентная электропроводность
- •3.2. Влияние различных факторов на электропроводность
- •3.2.1. Влияние природы электролита и растворителя
- •3.2.2. Влияние концентрации электролита
- •3.2.3. Влияние температуры
- •3.3. Методы кондуктометрического анализа
- •3.3.1. Прямая кондуктометрия
- •3.3.2.Кондуктометрическое титрование
- •3.3.2.1. Метод осаждения
- •3.3.2.2. Метод нейтрализации
- •II. Титрование слабой кислоты сильным основанием и наоборот.
- •3.3.2.3. Метод комплексонометрии
- •3.3.3. Измерение электропроводности растворов
- •3.4. Высокочастотное титрование
- •3.4.1. Теоретические основы и общие положения теории высокочастотного титрования
- •3.5. Потенциометрия
- •3.5.1. Классические электроды
- •3.5.2. Мембранные электроды
- •3.5.2.1. Электроды с твёрдой мембраной
- •3.5.2.2. Стеклянные электроды
- •3.5.2.3. Электроды с жесткими мембранами
- •I группа.
- •II группа:
- •3.5.3. Способы определения эдс
- •3.5.4. Методы потенциометрии
- •1) Прямая потенциометрия.
- •2) Метод добавок.
- •3.5.4.1. Метод осаждения.
- •3.5.4.2. Метод нейтрализации.
- •3.5.4.3. Окислительно-восстановительный метод
- •6. Сущность полярографического метода анализа
- •6.1. Основы метода.
- •6.2. Диффузный ток.
- •6.3. Уравнение Ильковича.
- •6.4. Полярографическая кривая
- •6.5. Капельный ртутный катод
- •6.6. Полярографический фон.
- •6.7. Область применения полярографического анализа
- •6.8 Методика полярографического анализа.
- •6.9. Полярографы.
2) Метод добавок.
Метод можно использовать как в прямой потенциометрии, так и при потенциометрическом титровании
В данном методе используются 2 раствора:
I – стандартный, с известными Vст и Сст
II – исследуемый, с известным Vx и неизвестной Сх
Сначала измеряют потенциал, исследуемого раствора Сх исходя из уравнения Нернста:
![]() ,
отсюда:
,
отсюда:
![]() (1)
(1)
Затем к известному объёму, исследуемого вещества Vx прибавляют известный объём Vст – стандартного раствора с концентрацией Сст, после чего определяют его потенциал.
Е2=
Е0
![]() ,
отсюда:
,
отсюда:
![]() ,
(2)
,
(2)
Решая совместно уравнения (1) и (2), находим концентрацию исследуемого раствора:

3) Потенциометрическое титрование.
Метод подразумевают любой потенциометрический способ определения концентрации, использующий добавление титранта к исследуемому раствору. При этом после каждого добавления титранта измеряется потенциал индикаторного электрода. Изменение потенциала будет увеличиваться по мере приближения к точке эквивалентности. Кривые потенциометрического титрования имеют характерный вид (рис. 27)
П
а б в
Рис. 27. Кривые
потенциометрического титрования:
а
– интегральная кривая; б
– дифференциальная кривая;
в
– кривая по второй производной.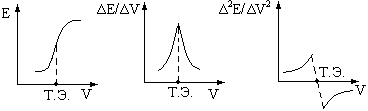
Преимуществом потенциометрического титрования перед обычным титрование является высокая точность, отсутствие субъективности, возможность титрования окрашенных и мутных растворов, возможность определения нескольких веществ без их предварительного разделения. Метод можно использовать и при отсутствии ионоселективных электродов, расширение круга электродов, используемых для определения концентрации Сх, нивелирует влияние примесей.
3.5.4.1. Метод осаждения.
В данном методе нет универсальных индикаторных электродов. В качестве индикаторного электрода используется электрод, потенциал которого зависит от концентрации одного из ионов, участвующих в реакции осаждения. В качестве электродов сравнения используют хлорсеребряный или каломельный электрод.
Пример: определение ионов Ag+ титрованием раствора AgNO3 100 мл 0,1 н раствора NaCl.
AgNO3 + NaCl = AgCl + NaNO3
Пусть объём AgNO3 равен 100 мл; концентрация AgNO3 10-1 моль/л. Для титрования используется серебряный электрод.
Рассчитаем кривую титрования по уравнению Нернста. При титровании по методу осаждения величину потенциала рассчитывают, подставляя в уравнение Нернста концентрацию, потенциал определяющего иона, т.е. концентрация потенциал определяющего иона рассчитывается по убыли (избытку) в растворе титрования.
1) Исходный раствор AgNO3, VNaCl = 0
![]() В
В
2) До Т.Э. добавим VNaCl =90 мл, следовательно осталось 10% Ag+, т.е. СAg+ = 0,01моль/л
![]() В
В
3) Точка эквивалентности
Концентрация
потенциал определяющего иона в точке
эквивалентности рассчитывается из
величины ПР данного осадка
![]() =10-10,
т.к. VAgNO
=VNaCl,
то
=10-10,
т.к. VAgNO
=VNaCl,
то
![]() ,
отсюда:
,
отсюда:
![]() моль/л
моль/л
![]() В
В
4) После точки эквивалентности. В этом случае концентрация потенциалопределяющего иона рассчитывается по избытку титранта,
Прибавим 0,1 % избыток NaCl (0,1 мл). Учитывая исходную концентрацию NaCl – 0,1 моль/л, при 0,1 % избытке NaCl – в растворе [Сl-] = 10 -4моль/л.
Из выражения ПРAgCl:
![]() моль/л
моль/л
![]() В
В
К
Рис.28
По методу осаждения можно определить несколько компонентов находящихся в растворе одновременно. При этом для того чтобы наблюдалось насколько скачков на кривой титрования необходимо чтобы ПР образующихся осадков различались не менее чем на 3 порядка, т.е.:
![]() 10
3
10
3
Причём, в начале титрования выпадает осадок с меньшим значением ПР, затем остальные осадки по мере увеличения ПР.
П
Рис.29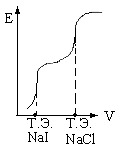
![]()
![]()
Сначала будет протекать реакция:
![]()
После полного выпадения будет протекать реакция:
![]()
Кривая титрования имеет вид рис. 29.
