
- •Шпора на экзамен по современной аналитической химии. Хроматография, масс-спектрометрия.
- •Уравнение Ван-Деемтера
- •Газовая хроматография. Хроматограф, колонки и прочие радости жизни.
- •Жидкостная хроматография и с чем её едят.
- •Капиллярный электрофорез
- •Тонкослойная хроматография
- •Масс-спектрометрия.
- •Типы ионизации.
- •Виды масс-анализаторов.
- •Принцип действия triple quadrupole систем
- •Системы типа QqTof не рассматриваются по причине их аналогичности описанным, за исключением того что окончание не квадруполь, а времяпролетник.
- •Качественный анализ в гх-мс
- •Количественный анализ в гх-мс
- •Матричные влияния и основные направления исследований.
- •Примеры использования хромато-масс-спектрометрии.
- •Наиболее распространенные вопросы:
Шпора на экзамен по современной аналитической химии. Хроматография, масс-спектрометрия.
Итак, начнем с хроматографии. Введение в хроматографию, виды хроматографии мы уже разобрали, но теперь поговорим о тех терминах и формулах, которые Вас, вероятно, будут спрашивать и которыми, может быть, будут нагружать.
Прежде всего Вы должны помнить, что основными величинами в хроматографии являются время удерживания и число теоретических тарелок.
Время удерживания (tR) – это время, прошедшее от момента
ввода пробы до выхода максимума концентрации определяемого компонента.
Число теоретических тарелок характеризует число ступеней установления равновесия распределения вещества между подвижной и неподвижной фазами, описывается уравнением:
N = 5,54⋅(t′R / b0,5)2
Где t′R – исправленное время удерживания.
Исправленным временем удерживания называется разность между временем удерживания компонента и мертвым временем (временем выхода не удерживаемого компонента).
Проще говоря, теоретической тарелкой можно назвать единичный акт сорбции/десорбции аналита.
Начав говорить об удерживании вещества, стоит сказать об основных терминах – сильно удерживаемые компоненты и не удерживаемые. Эти понятия довольно легко проиллюстрировать следующим образом:

Представьте, что витрина – это хроматографическая колонка. Люди – это компоненты вашей пробы. Кто-то проходит мимо, даже не взглянув на витрину (не удерживаемые компоненты), кто-то слегка замедлит шаг и посмотрит на витрину (слабо удерживаемые), а кого-то надо оттаскивать от витрины силой (сильно удерживаемые). Таким образом, удерживание компонентов пробы можно сравнить с усилием, которое надо приложить для того, чтобы оттянуть человека от витрины. Справедливости ради стоит отметить, что иногда соединения сорбируются необратимо.
Однако в хроматографии существует еще одна величина, использующаяся для характеристики эффективности хроматографической системы. Она называется высотой, эквивалентной теоретической тарелке (ВЭТТ). Высота, эквивалентная теоретической тарелке (ВЭТТ) (англ. height equivalent to a theoretical plate, HETP) — суммарная характеристика общей разделяющей способности хроматографической колонки. ВЭТТ определяется как отношение длины хроматографической колонки (L) к общему числу теоретических тарелок. Имеет обозначение H (мм) (да-да, это та самая Н из уравнения Ван-Деемтера, Вы не ошиблись ) и, как ясно из описания, рассчитывается следующим образом:
Н = L/N
L – длинна колонки
N – число теоретических тарелок
Уравнение Ван-Деемтера
Несмотря на то, что у Вас оно уже есть, я все же дам его еще раз, только на этот раз в более простом и разумном виде. Итак, сам график зависимости ВЭТТ от скорости потока выглядит следующим образом (в общем виде, конечно):
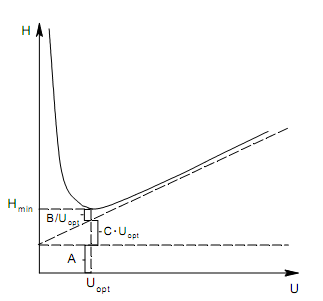
Само уравнение имеет следующий вид:
Н = А +B/U + C*Uopt
А – вклад вихревой диффузии;
B/U – продольная диффузия;
C*Uopt – сопротивление массопереносу.
В случае газовой хроматографии с капиллярными (именно с капиллярными) колонками вклад вихревой диффузии равен нулю, поскольку сорбента – нет и они имеют открытое поперечное сечение.
Селективность (фактор разделения) хроматографической системы при разделении двух веществ определяется экспериментально по формуле
a=t'R1/t'R2
Селективность – это способность хроматографической системы (адсорбента и подвижной фазы) делить данную пару соединений. В общем случае селективность является интегральным результатом межмолекулярных взаимодействий в хроматографической системе.
Разрешением (R) называется отношение расстояния между максимумами пиков к средней арифметической ширине обоих пиков у основания:
R = 2 * (tR1 - tR2)/(W1 + W2)
Для количественного анализа обычно достаточно разрешения R = 1, так как в этом случае только примерно 2% площади пиков перекрываются. Разрешение двух хроматографических пиков зависит от селективности хроматографической системы, удерживания сорбатов и эффективности хроматографической колонки.
Ну и, конечно, несколько терминов, которые применяются при описании хроматографических разделений:
Проба – аликвота анализируемой смеси, вводимая в хроматограф. Сорбат – компонент пробы, индивидуальное соединение.
Элюент (подвижная фаза ПФ) – растворитель или смесь растворителей, предназначенная для прокачки анализируемой смеси через хроматографическую колонку. ВНИМАНИЕ!!! В газовой хроматографии нет элюента, там используется другое понятие – газ-носитель. Он несет компоненты пробы через колонку.
Элюат – раствор, выходящий из хроматографической колонки.
