- •Практикум з органічної хімії Навчальний посібник
- •Загальні правила
- •Запобіжні заходи
- •Перша допомога при нещасних випадках
- •Лабораторна робота 1 методи очистки речовин
- •Перекристалізація
- •Перекристалізація речовин із органічних розчинників
- •Перегонка
- •Перегонка при атмосферному тиску
- •Дробна (фракційна) перегонка
- •Дослід 1.1. Перекристалізація бензойної кислоти
- •Дослід 1.2. Перегонка суміші бензолу і ксилолу
- •Контрольні запитання
- •Лабораторна робота 2 визначення основних фізичних констант органічних речовин
- •1. Визначення температури плавлення
- •2. Визначення температури кипіння
- •3. Визначення густини рідкої речовини
- •Маса води в об’ємі пікнометра при 4° с(х) 1
- •Маса 1 мл води при 4°с(х) 1
- •4. Визначення показника заломлюваності
- •Дослід 2.1. Визначення температури плавлення
- •Дослід 2.2. Визначення показника заломлення за допомогою рефрактометра ірф-22
- •Контрольні запитання
- •Лабораторна робота 3 якісний елементний аналіз органічних сполук
- •Дослід 3.1. Визначення вуглецю пробою на обвуглювання
- •Визначення вуглецю і водню спаленням речовини з оксидом міді (II)
- •Дослід 3.2. Визначення азоту сплавленням речовини з металічним натрієм
- •Хімізм процесу:
- •Дослід 3.3. Визначення сірки сплавленням речовини з металічним натрієм
- •Хімізм процесу:
- •Дослід 3.4. Визначення хлору за зеленим забарвленням полум’я (проба Бельштейна)
- •Хімізм процесу:
- •Дослід 3. 5. Визначення хлору дією металічного натрію на спиртовий розчин органічної речовини. (метод а. В. Степанова)
- •3.6. Якісне визначення фосфору
- •Контрольні запитання
- •Лабораторна робота 4 насичені вуглеводні Будова, ізомерія, номенклатура, властивості
- •Гомологічний ряд
- •Дослід 4.1. Синтез метану та вивчення його властивостей
- •Хімізм процесу:
- •Хімізм процесу:
- •Реакція метану на бромну воду і перманганат калію
- •Дослід 4.2. Галогенування насичених вуглеводнів
- •Дослід 4.3. Бромування насичених вуглеводнів
- •Хімізм процесу:
- •Окиснення парафінів
- •Дослід 4.4. Окиснення алканів
- •Дослід 4.5. Дія концентрованої сульфатної кислоти на насичені вуглеводні
- •Дослід 4.5. Дія концентрованої нітратної кислоти на насичені вуглеводні
- •Контрольні запитання
- •Лабораторна робота 5 алкени Будова, ізомерія, номенклатура, властивості
- •Дослід 5.1. Отримання етилену і його горіння
- •Хімізм процесу:
- •Дослiд 5.2. Приєднання до етилену брому
- •Хiмiзм процесу:
- •Дослiд 5.3. Взаємодiя з окиснювачами
- •Хiмiзм процесу:
- •Дослiд 5.4. Приєднання галогенів й галогеноводнів за кратним ланцюгом
- •Дослiд 5.5. Окиснення ненасичених вуглеводнів
- •Дослiд 5.6. Дія концентрованої сульфатної кислоти на ненасичені вуглеводні
- •Хімізм процесу:
- •Дослiд 5.7. Дія концентрованої нітратної кислоти на ненасичені вуглеводні
- •Контрольнi запитання
- •Лабораторна робота 6
- •Будова, iзомерiя, номенклатура I властивостi
- •Дослiд 6.1. Отримання ацетилену I його горiння
- •Хiмiзм процесу:
- •Дослiд 6.2. Приєднання брому до ацетилену
- •Хiмiзм процесу:
- •Дослiд 6.3. Реакцiя ацетилену з окиснювачами
- •Дослiд 6.4. Утворення ацетиленiду срiбла
- •Хiмiзм процесу:
- •Дослiд 6.5. Утворення ацетиленiду мiдi
- •Хiмiзм процесу:
- •Контрольнi запитання
- •Лабораторна робота 7 ароматичнi сполуки Будова, iзомерiя, номенклатура I властивостi
- •Дослiд 7.1. Синтез бензолу iз бензойнокислого натрiю
- •Хiмiзм процесу:
- •Дослiд 7.2. Синтез нiтробензолу
- •Хiмiзм процесу:
- •Вивчення властивостей бензолу Дослiд 7.3. Розчинність бензолу у різних розчинниках
- •Дослiд 7.4. Горіння бензолу
- •Дослiд 7.5. Дiя бромної води на бензол
- •Дослiд 7.6. Дiя перманганату калiю на бензол
- •Сульфування аренів
- •Дослiд 7.7. Отримання бензолсульфокислоти
- •Окиснення аренів
- •Дослiд 7.8. Окиснення гомологiв бензолу
- •Контрольнi запитання
- •Лабораторна робота 8 галогенопохiднi вуглеводнi Будова, iзомерiя, номенклатура I властивостi
- •Дослiд 8.1. Синтез бромистого етилу
- •Хімізм процесу:
- •Дослiд 8.2. Синтез хлористого етилу
- •Хiмiзм процесу:
- •Дослiд 8.3. Синтез йодоформу з етилового спирту
- •Дослiд 8.4. Отримання бромбензолу
- •Хiмiзм процесу:
- •Дослiд 8.5. Вплив каталізаторів на хід бромування вуглеводнів
- •Хімізм процесу:
- •Контрольнi запитання
- •Лабораторна робота 9 спирти I простi ефiри Будова, iзомерiя, номенклатура I властивостi
- •Дослiд 9.1. Визначення будови спиртів
- •Дослiд 9.2. Утворення I гiдролiз алкоголятiв
- •Хiмiзм процесу:
- •Дослiд 9.3. Окиснення етилового спирту оксидом мiдi (II)
- •Хiмiзм процесу:
- •Дослiд 9.4. Окиснення етилового спирту перманганатом калiю
- •Хiмiзм процесу:
- •Дослiд 9.5. Синтез дiетилового ефiру
- •Хiмiзм процесу:
- •Дослiд 9.7. Взаємодiя глiцерину з гiдроксидом мiдi (II)
- •Хiмiзм процесу:
- •Контрольнi запитання
- •Лабораторна робота 10 феноли Будова, iзомерiя, номенклатура I властивостi
- •Дослiд 10.1. Реакцiя фенолу з хлоридом залiза (III)
- •Дослiд 10.2. Отримання трибромфенолу
- •Хiмiзм процесу:
- •Дослiд 10.3. Сульфування фенолу
- •Хiмiзм процесу:
- •Дослiд 10.4. Нітрування фенолу
- •Дослiд 10.5. Кольоровi реакцiї багатоатомних фенолiв
- •Дослiд 10.7. Отримання ауріну
- •Хімізм процесу:
- •Контрольнi запитання
- •Лабораторна робота 11 альдегіди і кетони Будова, iзомерiя, номенклатура I властивостi
- •Дослiд 11.1. Отримання ацетальдегіду із ацетилену (за реакцією м.Г. Кучерова)
- •Хімізм процесу:
- •Дослiд 11.2. Отримання фенілгідразону оцтового альдегіду
- •Хімізм процесу:
- •Дослiд 11.3. Отримання ацетону із оцтовокислого натрію
- •Хімізм процесу:
- •Окиснення карбонільних сполук
- •Дослiд 11.4. Окиснення альдегiдiв амiачним розчином оксиду срiбла (реакцiя "срiбного дзеркала")
- •Хiмiзм процесу:
- •Дослiд 11.5. Окиснення альдегiдiв гiдроксидом мiдi (II)
- •Дослiд 11.8. Якiсна реакцiя на ацетон з нiтропрусидом натрiю
- •Дослiд 11.9. Реакцiя ацетону з гiдросульфiтом натрiю
- •Хiмiзм процесу:
- •Дослiд 11.10. Дiя ацетону на пластмаси
- •Контрольнi запитання
- •Лабораторна робота 12 карбонові кислоти та їхні похідні Будова, iзомерiя, номенклатура I властивостi
- •Двоосновнi кислоти та їхні похiднi
- •Дослiд 12.1. Розчиннiсть кислот у водi
- •Кислотнi властивостi карбонових кислот Дослiд 12.2. Дiя оцтової кислоти на iндикатори
- •Дослiд 12.3. Взаємодiя з металами
- •Дослiд 12.4. Взаємодiя з солями
- •Хiмiзм процесу:
- •Дослід 12.5. Отримання мурашиної кислоти з хлороформу та її відкриття
- •Дослід 12.6. Отримання натрієвої солі щавлевої кислоти
- •Хімізм процесу:
- •Дослід 12.7. Відкриття щавлевої кислоти у вигляді кальцевої солі
- •Реакцiя карбонових кислот нa окислювачi
- •Хiмiзм процесу:
- •Контрольнi запитання
- •Лабораторна робота 13 складні ефіри, жири і оливи
- •Жири та оливи
- •Дослiд 13.1. Отримання бензойноетилового ефiру
- •Хiмiзм процесу:
- •Дослід 13.2. Порівняти розчинність рослинних олив у різних розчинниках Екстрагування жиру на папері
- •Дослід 13.3. Емульгування жирів
- •Дослiд 13.4. Визначення ступеня ненасиченостi жиру (взаємодiя жиру з бромною водою)
- •Хiмiзм процесу:
- •Дослiд 13.5. Визначення ненасиченостi жиру за допомогою спиртового розчину йоду
- •Дослiд 13.6. Окислення рослинних олій перманганатом калiю
- •Хiмiзм процесу:
- •Дослід 13.7. Омилення жирів у водно-спиртовому розчині
- •Хімізм процесу:
- •Дослiд 13.8 . Розчиннiсть мила у водi
- •Дослід 13.9. Виділення вільних жирних кислот із мила
- •Хімізм процесу:
- •Дослід 13.10. Доказ ненасиченості жирних кислот, що входять до складу мила
- •Дослiд 13.11. Гiдролiз спиртового розчину мила
- •Хімізм процесу:
- •Контрольнi запитання
- •Лабораторна робота 14 моносахариди Поняття про оптичну iзомерiю
- •Будова, номенклатура I властивостi
- •Дослiд 14.1. Доказ присутностi гiдроксильних груп у глюкозi
- •Хімізм процесу:
- •Дослiд 14.2. Окислення глюкози гiдроксидом мiдi (II) в присутностi лугу (проба Тримера)
- •Хімізм процесу:
- •Дослiд 14.3. Окислення глюкози реактивом Фелiнга
- •Реакцiї альдегiдної групи Дослiд 14.4. Окиснення глюкози амiачним розчином оксиду срiбла (реакцiя "срiбного дзеркала")
- •Хiмiзм процесу:
- •Дослід 14.5. Реакція Селіванова на кетони
- •Контрольнi запитання
- •Лабораторна робота 15 полісахариди Класифiкацiя, номенклатура
- •Дослiд 15.1. Доказ наявностi гiдроксильних груп у сахарозi
- •Дослiд 15.2. Вiдсутнiсть вiдновлювальних властивостей у сахарози
- •Дослiд 15.3. Кислотний гiдролiз сахарози
- •Хiмiзм процесу:
- •Дослiд 15.4. Реакцiя крохмалю з йодом
- •Дослiд 15.5. Кислотний гiдролiз крохмалю
- •Хiмiзм процесу:
- •Дослід 15.6. Ферментативний гідроліз крохмалю
- •Дослід 15.8. Взаємодія клітковини з лугом
- •Дослід 15.9. Отримання амілоїду з клітковини
- •Дослiд 15.10. Кислотний гiдролiз клiтковини
- •Хiмiзм процесу:
- •Дослiд 15.11. Отримання азотнокислих ефiрiв клiтковини
- •Хiмiзм процесу:
- •Дослід 15.12. Отримання триацетату клітковини
- •Хімізм процесу:
- •Контрольнi запитання
- •Лабораторна робота 16 аміни. Амінокислоти і аміди кислот Будова, iзомерiя, номенклатура I властивостi
- •Дослiд 16.1. Отримання метиламiну з ацетамiду
- •Хiмiзм процесу:
- •Дослiд 16.2. Властивостi амiнiв жирного ряду
- •Хiмiзм процесу:
- •Хімізм процесу:
- •Дослiд 16.3. Одержання анiлiну з нiтробензолу
- •Хiмiзм процесу:
- •Дослiд 16.4. Розчиннiсть анiлiну у водi
- •Дослiд 16.5. Утворення солей анiлiну та їхній розклад
- •Хімізм процесу:
- •Хiмiзм процесу:
- •Дослiд 16.6. Кольоровi реакцii анiлiну
- •Дослiд 16.7. Бромування анiлiну
- •Дослід 16.8. Конденсація аніліну з формальдегідом
- •Дослiд 16.9. Реакцiя амiнокислот на iндикатори
- •Дослiд 16.11. Дiя азотистої кислоти на амiнокислоти
- •Хiмiзм процесу:
- •Дослід 16.12. Конденсація сечовини з формальдегідом. Отримання полімеру
- •Дослiд 16.13. Дiя мурашиного альдегiду на амiнокислоти
- •Хiмiзм процесу:
- •Контрольнi запитання
- •Лабораторна робота 17 білкові речовини
- •Дослiд 17.1. Кольоровi реакцiї на бiлки
- •Дослiд 17.2. Буфернi властивостi розчину бiлкiв
- •Дослід 17.4. Осадження білків концентрованими мінеральними кислотами
- •Дослiд 17.5. Осадження бiлкiв солями важких металiв
- •Контрольнi запитання
- •Лабораторна робота 18 гетероциклічні сполуки
- •Дослiд 18.1. Отримання кофеїну з чаю
- •Дослід 18.2. Отримання фурфуролу
- •Дослiд 18.2. Якiснi реакцiї фурфуролу
- •Дослiд 18.3. Властивостi пiридину
- •Хiмiзм процесу:
- •Контрольнi запитання
- •Будова та назва функціональних груп органічних молекул
- •Основні позначення при кількісних розрахунках по хімії
- •ЛІтература
- •49000, М. Дніпропетровськ, вул. Бердянська, 61
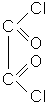
Двоосновнi кислоти та їхні похiднi
|
|
|
етандіова кислота; щавлева кислота |
хлористий оксаліл |
диметилоксалат; диметиловий ефір щавлевої кислоти |
Карбоксильна група - приклад взаємного впливу атомiв у молекулi. Карбонiльна група -С=О , яка в нiй мiститься, вже не має своїх специфiчних властивостей, тому що другий кiнець притягує до себе електрони вiд кисню гiдроксильної групи. Кисень гiдроксилу менш мiцно утримує атом водню i, таким чином, стає можливою дисоцiацiя, характерна для розчинiв карбонових кислот:

Такий запис неточний, бо в утвореному карбоксиланiонi негативний заряд належить в однаковiй мiрi обом атомам кисню, i його структура записується так:

Структура солей карбонових кислот може бути зображена так:

Для IЧ-спектрiв карбонових кислот характерна сильна смуга в областi 1700 см-1 (валентнi коливання С=О) i 2500-3000 см-1 (валентнi коливання О-Н). В складних ефiрах остання вiдсутня, але є двi сильнi смуги при 1050-1300 см-1 (валентнi коливання С-О).
Жири
Жири (триглiцериди) - сумiш складних ефiрiв триатомного спирту глiцерину

i вищих карбонових кислот, серед яких переважають пальмiтинова C15H31COOH, стеаринова C17H35COOH, олеїнова C17H33COOH або CH3(CH2)7CH=CH(CH2)7COOH кислоти.
Жири називають, використовуючи звичайну номенклатуру складних ефiрiв або називаючи тiльки залишки кислот, i додають до останнього залишку закiнчення "-ин" ("-ін"):
При лужному гiдролiзi жирiв утворюється глiцерин i мило - сiль вищої кислоти: стеарат натрiю.
|
|
дипальмітостеарин; дипальмітостеарат гліцерину |
триолеїн; триолеат гліцерину |
Дослiд 12.1. Розчиннiсть кислот у водi
Реактиви та матеріали: |
кислоти (оцтова, масляна, iзомасляна, акрилова, стеаринова, олеїнова, щавлева, малонова) |
Обладнання: |
пробiрки, скляна паличка, пiпетка, пальник |
3 краплi або декiлька кристалiв кожної з кислот змiшують у пробiрцi з 5 крап-лями води. Якщо кислота не розчиняється, пробiрку нагрiвають. Гарячi розчини охо-лоджують i спостерiгають видiлення кристалiв кислот, якi розчиняються тiльки при нагрiваннi. Для усiх паралельних проб беруть однакову кiлькість кислоти i розчинника.
Кислотнi властивостi карбонових кислот Дослiд 12.2. Дiя оцтової кислоти на iндикатори
Реактиви та матеріали: |
оцтова кислота (0,1Н розчин); метилоранж; лакмус; 1%-ний спиртовий розчин фенолфталеїну |
Обладнання: |
пробiрки, скляна паличка, пiпетка, пальник |
У три пробiрки наливають по 3 краплi розчину оцтової кислоти. В першу додають краплю метилоранжу, в другу - лакмусу, в третю - фенолфталеїну. В пробiрцi з метиловим оранжевим з'являється червоне забарвлення, в пробiрцi з лакмусом - рожеве, з фенолфталеїном - лишається безбарвним.