- •Практикум з органічної хімії Навчальний посібник
- •Загальні правила
- •Запобіжні заходи
- •Перша допомога при нещасних випадках
- •Лабораторна робота 1 методи очистки речовин
- •Перекристалізація
- •Перекристалізація речовин із органічних розчинників
- •Перегонка
- •Перегонка при атмосферному тиску
- •Дробна (фракційна) перегонка
- •Дослід 1.1. Перекристалізація бензойної кислоти
- •Дослід 1.2. Перегонка суміші бензолу і ксилолу
- •Контрольні запитання
- •Лабораторна робота 2 визначення основних фізичних констант органічних речовин
- •1. Визначення температури плавлення
- •2. Визначення температури кипіння
- •3. Визначення густини рідкої речовини
- •Маса води в об’ємі пікнометра при 4° с(х) 1
- •Маса 1 мл води при 4°с(х) 1
- •4. Визначення показника заломлюваності
- •Дослід 2.1. Визначення температури плавлення
- •Дослід 2.2. Визначення показника заломлення за допомогою рефрактометра ірф-22
- •Контрольні запитання
- •Лабораторна робота 3 якісний елементний аналіз органічних сполук
- •Дослід 3.1. Визначення вуглецю пробою на обвуглювання
- •Визначення вуглецю і водню спаленням речовини з оксидом міді (II)
- •Дослід 3.2. Визначення азоту сплавленням речовини з металічним натрієм
- •Хімізм процесу:
- •Дослід 3.3. Визначення сірки сплавленням речовини з металічним натрієм
- •Хімізм процесу:
- •Дослід 3.4. Визначення хлору за зеленим забарвленням полум’я (проба Бельштейна)
- •Хімізм процесу:
- •Дослід 3. 5. Визначення хлору дією металічного натрію на спиртовий розчин органічної речовини. (метод а. В. Степанова)
- •3.6. Якісне визначення фосфору
- •Контрольні запитання
- •Лабораторна робота 4 насичені вуглеводні Будова, ізомерія, номенклатура, властивості
- •Гомологічний ряд
- •Дослід 4.1. Синтез метану та вивчення його властивостей
- •Хімізм процесу:
- •Хімізм процесу:
- •Реакція метану на бромну воду і перманганат калію
- •Дослід 4.2. Галогенування насичених вуглеводнів
- •Дослід 4.3. Бромування насичених вуглеводнів
- •Хімізм процесу:
- •Окиснення парафінів
- •Дослід 4.4. Окиснення алканів
- •Дослід 4.5. Дія концентрованої сульфатної кислоти на насичені вуглеводні
- •Дослід 4.5. Дія концентрованої нітратної кислоти на насичені вуглеводні
- •Контрольні запитання
- •Лабораторна робота 5 алкени Будова, ізомерія, номенклатура, властивості
- •Дослід 5.1. Отримання етилену і його горіння
- •Хімізм процесу:
- •Дослiд 5.2. Приєднання до етилену брому
- •Хiмiзм процесу:
- •Дослiд 5.3. Взаємодiя з окиснювачами
- •Хiмiзм процесу:
- •Дослiд 5.4. Приєднання галогенів й галогеноводнів за кратним ланцюгом
- •Дослiд 5.5. Окиснення ненасичених вуглеводнів
- •Дослiд 5.6. Дія концентрованої сульфатної кислоти на ненасичені вуглеводні
- •Хімізм процесу:
- •Дослiд 5.7. Дія концентрованої нітратної кислоти на ненасичені вуглеводні
- •Контрольнi запитання
- •Лабораторна робота 6
- •Будова, iзомерiя, номенклатура I властивостi
- •Дослiд 6.1. Отримання ацетилену I його горiння
- •Хiмiзм процесу:
- •Дослiд 6.2. Приєднання брому до ацетилену
- •Хiмiзм процесу:
- •Дослiд 6.3. Реакцiя ацетилену з окиснювачами
- •Дослiд 6.4. Утворення ацетиленiду срiбла
- •Хiмiзм процесу:
- •Дослiд 6.5. Утворення ацетиленiду мiдi
- •Хiмiзм процесу:
- •Контрольнi запитання
- •Лабораторна робота 7 ароматичнi сполуки Будова, iзомерiя, номенклатура I властивостi
- •Дослiд 7.1. Синтез бензолу iз бензойнокислого натрiю
- •Хiмiзм процесу:
- •Дослiд 7.2. Синтез нiтробензолу
- •Хiмiзм процесу:
- •Вивчення властивостей бензолу Дослiд 7.3. Розчинність бензолу у різних розчинниках
- •Дослiд 7.4. Горіння бензолу
- •Дослiд 7.5. Дiя бромної води на бензол
- •Дослiд 7.6. Дiя перманганату калiю на бензол
- •Сульфування аренів
- •Дослiд 7.7. Отримання бензолсульфокислоти
- •Окиснення аренів
- •Дослiд 7.8. Окиснення гомологiв бензолу
- •Контрольнi запитання
- •Лабораторна робота 8 галогенопохiднi вуглеводнi Будова, iзомерiя, номенклатура I властивостi
- •Дослiд 8.1. Синтез бромистого етилу
- •Хімізм процесу:
- •Дослiд 8.2. Синтез хлористого етилу
- •Хiмiзм процесу:
- •Дослiд 8.3. Синтез йодоформу з етилового спирту
- •Дослiд 8.4. Отримання бромбензолу
- •Хiмiзм процесу:
- •Дослiд 8.5. Вплив каталізаторів на хід бромування вуглеводнів
- •Хімізм процесу:
- •Контрольнi запитання
- •Лабораторна робота 9 спирти I простi ефiри Будова, iзомерiя, номенклатура I властивостi
- •Дослiд 9.1. Визначення будови спиртів
- •Дослiд 9.2. Утворення I гiдролiз алкоголятiв
- •Хiмiзм процесу:
- •Дослiд 9.3. Окиснення етилового спирту оксидом мiдi (II)
- •Хiмiзм процесу:
- •Дослiд 9.4. Окиснення етилового спирту перманганатом калiю
- •Хiмiзм процесу:
- •Дослiд 9.5. Синтез дiетилового ефiру
- •Хiмiзм процесу:
- •Дослiд 9.7. Взаємодiя глiцерину з гiдроксидом мiдi (II)
- •Хiмiзм процесу:
- •Контрольнi запитання
- •Лабораторна робота 10 феноли Будова, iзомерiя, номенклатура I властивостi
- •Дослiд 10.1. Реакцiя фенолу з хлоридом залiза (III)
- •Дослiд 10.2. Отримання трибромфенолу
- •Хiмiзм процесу:
- •Дослiд 10.3. Сульфування фенолу
- •Хiмiзм процесу:
- •Дослiд 10.4. Нітрування фенолу
- •Дослiд 10.5. Кольоровi реакцiї багатоатомних фенолiв
- •Дослiд 10.7. Отримання ауріну
- •Хімізм процесу:
- •Контрольнi запитання
- •Лабораторна робота 11 альдегіди і кетони Будова, iзомерiя, номенклатура I властивостi
- •Дослiд 11.1. Отримання ацетальдегіду із ацетилену (за реакцією м.Г. Кучерова)
- •Хімізм процесу:
- •Дослiд 11.2. Отримання фенілгідразону оцтового альдегіду
- •Хімізм процесу:
- •Дослiд 11.3. Отримання ацетону із оцтовокислого натрію
- •Хімізм процесу:
- •Окиснення карбонільних сполук
- •Дослiд 11.4. Окиснення альдегiдiв амiачним розчином оксиду срiбла (реакцiя "срiбного дзеркала")
- •Хiмiзм процесу:
- •Дослiд 11.5. Окиснення альдегiдiв гiдроксидом мiдi (II)
- •Дослiд 11.8. Якiсна реакцiя на ацетон з нiтропрусидом натрiю
- •Дослiд 11.9. Реакцiя ацетону з гiдросульфiтом натрiю
- •Хiмiзм процесу:
- •Дослiд 11.10. Дiя ацетону на пластмаси
- •Контрольнi запитання
- •Лабораторна робота 12 карбонові кислоти та їхні похідні Будова, iзомерiя, номенклатура I властивостi
- •Двоосновнi кислоти та їхні похiднi
- •Дослiд 12.1. Розчиннiсть кислот у водi
- •Кислотнi властивостi карбонових кислот Дослiд 12.2. Дiя оцтової кислоти на iндикатори
- •Дослiд 12.3. Взаємодiя з металами
- •Дослiд 12.4. Взаємодiя з солями
- •Хiмiзм процесу:
- •Дослід 12.5. Отримання мурашиної кислоти з хлороформу та її відкриття
- •Дослід 12.6. Отримання натрієвої солі щавлевої кислоти
- •Хімізм процесу:
- •Дослід 12.7. Відкриття щавлевої кислоти у вигляді кальцевої солі
- •Реакцiя карбонових кислот нa окислювачi
- •Хiмiзм процесу:
- •Контрольнi запитання
- •Лабораторна робота 13 складні ефіри, жири і оливи
- •Жири та оливи
- •Дослiд 13.1. Отримання бензойноетилового ефiру
- •Хiмiзм процесу:
- •Дослід 13.2. Порівняти розчинність рослинних олив у різних розчинниках Екстрагування жиру на папері
- •Дослід 13.3. Емульгування жирів
- •Дослiд 13.4. Визначення ступеня ненасиченостi жиру (взаємодiя жиру з бромною водою)
- •Хiмiзм процесу:
- •Дослiд 13.5. Визначення ненасиченостi жиру за допомогою спиртового розчину йоду
- •Дослiд 13.6. Окислення рослинних олій перманганатом калiю
- •Хiмiзм процесу:
- •Дослід 13.7. Омилення жирів у водно-спиртовому розчині
- •Хімізм процесу:
- •Дослiд 13.8 . Розчиннiсть мила у водi
- •Дослід 13.9. Виділення вільних жирних кислот із мила
- •Хімізм процесу:
- •Дослід 13.10. Доказ ненасиченості жирних кислот, що входять до складу мила
- •Дослiд 13.11. Гiдролiз спиртового розчину мила
- •Хімізм процесу:
- •Контрольнi запитання
- •Лабораторна робота 14 моносахариди Поняття про оптичну iзомерiю
- •Будова, номенклатура I властивостi
- •Дослiд 14.1. Доказ присутностi гiдроксильних груп у глюкозi
- •Хімізм процесу:
- •Дослiд 14.2. Окислення глюкози гiдроксидом мiдi (II) в присутностi лугу (проба Тримера)
- •Хімізм процесу:
- •Дослiд 14.3. Окислення глюкози реактивом Фелiнга
- •Реакцiї альдегiдної групи Дослiд 14.4. Окиснення глюкози амiачним розчином оксиду срiбла (реакцiя "срiбного дзеркала")
- •Хiмiзм процесу:
- •Дослід 14.5. Реакція Селіванова на кетони
- •Контрольнi запитання
- •Лабораторна робота 15 полісахариди Класифiкацiя, номенклатура
- •Дослiд 15.1. Доказ наявностi гiдроксильних груп у сахарозi
- •Дослiд 15.2. Вiдсутнiсть вiдновлювальних властивостей у сахарози
- •Дослiд 15.3. Кислотний гiдролiз сахарози
- •Хiмiзм процесу:
- •Дослiд 15.4. Реакцiя крохмалю з йодом
- •Дослiд 15.5. Кислотний гiдролiз крохмалю
- •Хiмiзм процесу:
- •Дослід 15.6. Ферментативний гідроліз крохмалю
- •Дослід 15.8. Взаємодія клітковини з лугом
- •Дослід 15.9. Отримання амілоїду з клітковини
- •Дослiд 15.10. Кислотний гiдролiз клiтковини
- •Хiмiзм процесу:
- •Дослiд 15.11. Отримання азотнокислих ефiрiв клiтковини
- •Хiмiзм процесу:
- •Дослід 15.12. Отримання триацетату клітковини
- •Хімізм процесу:
- •Контрольнi запитання
- •Лабораторна робота 16 аміни. Амінокислоти і аміди кислот Будова, iзомерiя, номенклатура I властивостi
- •Дослiд 16.1. Отримання метиламiну з ацетамiду
- •Хiмiзм процесу:
- •Дослiд 16.2. Властивостi амiнiв жирного ряду
- •Хiмiзм процесу:
- •Хімізм процесу:
- •Дослiд 16.3. Одержання анiлiну з нiтробензолу
- •Хiмiзм процесу:
- •Дослiд 16.4. Розчиннiсть анiлiну у водi
- •Дослiд 16.5. Утворення солей анiлiну та їхній розклад
- •Хімізм процесу:
- •Хiмiзм процесу:
- •Дослiд 16.6. Кольоровi реакцii анiлiну
- •Дослiд 16.7. Бромування анiлiну
- •Дослід 16.8. Конденсація аніліну з формальдегідом
- •Дослiд 16.9. Реакцiя амiнокислот на iндикатори
- •Дослiд 16.11. Дiя азотистої кислоти на амiнокислоти
- •Хiмiзм процесу:
- •Дослід 16.12. Конденсація сечовини з формальдегідом. Отримання полімеру
- •Дослiд 16.13. Дiя мурашиного альдегiду на амiнокислоти
- •Хiмiзм процесу:
- •Контрольнi запитання
- •Лабораторна робота 17 білкові речовини
- •Дослiд 17.1. Кольоровi реакцiї на бiлки
- •Дослiд 17.2. Буфернi властивостi розчину бiлкiв
- •Дослід 17.4. Осадження білків концентрованими мінеральними кислотами
- •Дослiд 17.5. Осадження бiлкiв солями важких металiв
- •Контрольнi запитання
- •Лабораторна робота 18 гетероциклічні сполуки
- •Дослiд 18.1. Отримання кофеїну з чаю
- •Дослід 18.2. Отримання фурфуролу
- •Дослiд 18.2. Якiснi реакцiї фурфуролу
- •Дослiд 18.3. Властивостi пiридину
- •Хiмiзм процесу:
- •Контрольнi запитання
- •Будова та назва функціональних груп органічних молекул
- •Основні позначення при кількісних розрахунках по хімії
- •ЛІтература
- •49000, М. Дніпропетровськ, вул. Бердянська, 61
Дослiд 9.7. Взаємодiя глiцерину з гiдроксидом мiдi (II)
Реактиви та матеріали: |
глiцерин, сульфат мiдi (0,2М розчин), їдкий натр (2Н розчин) |
Обладнання: |
пробiрки, пiпетки |
У пробiрку вносять 2 краплi розчину сульфату мiдi, 2 краплi розчину їдкого нат-ру i перемiшують - утворюється блакитний драглистий осад гiдроксиду мiдi (II). Дода-ють краплю глiцерину i розмiшують. Осад розчиняється i з’являється темно-синiй колiр внаслiдок утворення глiцерату мiдi.
Хiмiзм процесу:

Глiцерин - трьохатомний спирт. Кислотнiсть його бiльша, нiж одноатомних спиртiв; збiльшення числа гiдроксильних груп пiдвищує кислотний характер.
Глiцерин легко утворює глiцерати з гiдроксидами важких металiв. Але здатнiсть його утворювати металiчнi похiднi (глiцерати) з багатовалентними металами поясню-ється не стiльки його пiдвищеною кислотнiстю, скiльки тим, що при цьому утворю-ються внутрiшньокомплекснi сполуки, якi вiдзначаються особливою стiйкiстю. Спо-луки такого типу часто називають хелатними (вiд грецького “хела” - клешня).
Контрольнi запитання
Напишiть структурнi формули сполук: 2-метилпентанол-3; 2,2,4-триметилпента-нол-3; 2-метилбутанол-1; 2-метилбутин-3-ол-2.
Напишiть структурнi формули первинних, вторинних i третинних спиртiв складу С6H13OH. Назвiть їх.
Отримайте метилпропiловий ефiр за допомогою спиртiв i наведiть хiмiзм процесу.
Отримайте спирти за допомогою реакцiй Гриньяра, маючи: формальдегiд i бромистий пропiлмагнiй; бутанон-2 i бромистий втор-бутилмагнiй.
Якi спирти утворюються в результатi лужного гiдролiзу: бромистого вторбутилу; 1-йод-2-метилпентану; 3-бромбутену-1?
Лабораторна робота 10 феноли Будова, iзомерiя, номенклатура I властивостi
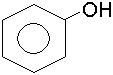
Органiчнi сполуки, в яких гiдроксил приєднується до атома вуглецю ароматич-ного ядра, називаються фенолами.
За кiлькiстю гiдроксильних груп феноли дiляться на одно- i багатоатомнi, наприклад:
|
|
|
|
фенол; оксибензол; карболова кислота |
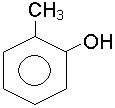
о-крезол; о-окситолуол |
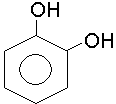
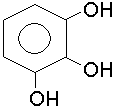
пірокатехін; о-діоксибензол |
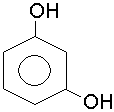
резорцин; м-діоксибензол |
|
|
|
гідрохінон; п-діоксибензол |
пірогалол; 1,2,3-триоксибензол; ряд - триоксибензол |
флороглюцин; 1,3,5- або сим-триоксибензол |
Властивостi фенолiв пояснюються їхнього електронною будовою:

Неподiлена електронна пара атомiв кисню перебуває у сполученнi з p-елек-тронами бензольного ядра i притягується до ядра. Це зменшує електронну густину бiля атома кисню i вiн слабше, нiж у спиртах, притягує атом водню. Виникає значно бiльша, нiж у спиртiв, можливiсть дисоцiацiї у фенолiв зв’язку О-Н з вiдщепленням протона, i у водних розчинах феноли поводяться як слабкi кислоти:
C6H5OH C6H5O- + H+
2C6H5OH + 2Na ® 2C6H5ONa + H2
На вiдмiну вiд спиртiв феноли можуть утворювати феноляти i при дiї водних розчинiв лугiв:
C6H5OH + NaOH ® C6H5ONa + H2O
Проте феноли - дуже слабкi кислоти: вони не забарвлюють лакмус у червоний колiр, солетворнi похiднi їх - феноляти - у водних розчинах сильно гiдролiзованi i навiть такi слабкi кислоти, як вугiльна, витісняють iз фенолятiв вiльнi феноли:
C6H5ONa + CO2 + H2O ® C6H5OH + NaHCO3
Такий вплив ароматичного ядра на гiдроксильну групу. Але i гiдроксильна група, в свою чергу, впливає на властивостi ароматичного ядра. Внаслiдок спряження p-електронної системи бензольного ядра з неподiленими електронами атома кисню збiльшується його активнiсть в електрофiльних реакцiях. Розрахована електронна густина на атомах вуглецю в молекулi фенолу: