- •Свойства протеиногенных аминокислот.
- •Вопрос 3. По способу свертывания и ассоциации полипептидных цепей выделяют четыре уровня пространственной структуры белка.
- •Особенности аминокислотного состава некоторых белков
- •Типы химических связей, участвующих в образовании структур белка.
- •Вопрос 4. Строгая классификация белков отсутствует. Основные принципы их классификации основываются на различии в физико-химических свойствах, структурных особенностях и функциональном предназначении.
Тема1. Общие сведения о белках. (4 часа).
Вопрос 1. Элементарный состав белков.
Вопрос 2. Полипептидная теория химического строения белков.
Вопрос 3. Пространственное строение белков. Типы химических связей в белках.
Вопрос 4. Классификация белков.
Вопрос 5. Биосинтез белков и его регуляция.
Вопрос 1. Белки, или протеины (от греч. protos – первый, важнейший), являются важнейшим классом органических соединений, играющим основополагающую роль в жизнедеятельности любой живой клетки. На долю белков приходится не менее 50 % сухой массы органических веществ клетки. Учитывая разнообразие живых организмов можно судить о существовании нескольких миллиардов химически индивидуальных белков, отличающихся как структурой, так и функциями. Например, клетка кишечной палочки содержит 3000 различных белков, а человеческий организм ~1млн.
Средний элементарный состав большинства белков (%): углерод – 50-54; кислород – 20-23; азот – 15-18; водород – 6-8; сера 0,3-2,5. Однако в мире белков существуют исключения, например в белках – протаминах содержание азота достигает 30 %.
Роль структурных элементов в белках выполняют L-изомеры α-аминокислот, отличающиеся друг от друга боковыми радикалами. Именно их специфические особенности придают каждому белку индивидуальность и влияют на его биологические и физико-химические свойства.
В настоящее время приняты три основных типа классификации аминокислот:
- Структурная — по строению бокового радикала;
- Биологическая или физиологическая — по степени незаменимости амино-
кислот для организма;
- Электрохимическая — по кислотно-основным свойствам аминокислот.
Для удобства записи структуры белков и пептидов предложены три основных способа сокращенного обозначения протеиногенных аминокислот:
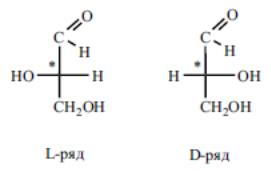
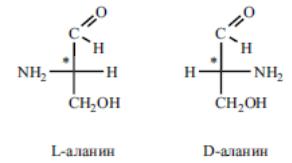
Оптическая изомерия аминокислот. Все протеиногенные аминокислоты кроме глицина — оптически активны и имеют как минимум один хиральный центр и принадлежат, как уже упоминалось к L-ряду. Интересно отметить, что L-аминокислоты имеют сладкий вкус, a D-изомеры без- вкусны или горькие.
Принадлежность аминокислот к L- или D-ряду определяется по расположению функциональных групп у хирального атома углерода, несущего аминогруппу, в срав- нении с глицериновым альдегидом.
Однако ряд протеиногенных аминокислот имеет несколько хиральных центров и несколько оптических изомеров может принадлежать к L-ряду. Так, например, треонин имеет два хиральных центра (n = 2) и соответственно 2n = 22 = 4 оптических изомера. Из этих двух оптических изомеров именно L-треонин входит в состав природных белков:
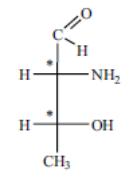
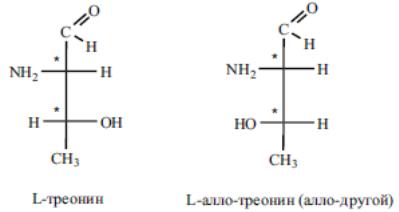
Еще два оптических изомера треонина относятся к D-ряду и в составе белков не обнаруживаются.
Свойства протеиногенных аминокислот.
Физические свойства. α-Аминокислоты — кристаллические вещества. Они имеют высокую температуру плавления (более 200 °С), нелетучи, нерастворимы в неполярных органических растворителях, хорошо растворимы в воде (важный фактор, обеспечивающий полноценную всасываемость и транспорт аминокислот в организме).
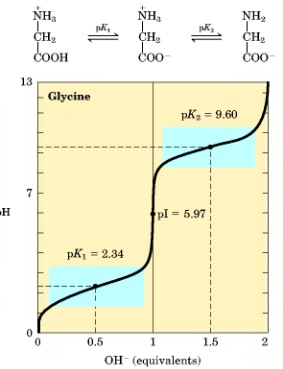
Кислотно-основные свойства. Аминокислоты проявляют амфотерные свойства (проявляют свойства кислот и оснований). Основными группами служат:
Карбоксилат-ион
![]()
Аминогруппа
![]()
Для каждой аминокислоты имеется, как минимум две константы кислотной диссоциации рКа: одна для карбоксильной группы (в пределах 1,8-5,5), а другая – для протонированной аминогруппы (в пределах 9-13). Состояние аминокислоты, когда её суммарный электрический заряд равен нулю, называется электрическим, а значение рН, обуславливающее это состояние называется изоэлектрической точкой аминокислоты рI (для каждой аминокислоты строго определенное). Для аминокислот рI совпадает с изоионной точкой (pJ) – величиной рН, при которой молекула белка содержит равное число положительно и отрицательно заряженных групп, образовавшихся в результате свертывания основных групп с протонами и соответствующей диссоциации кислых групп (у основных аминокислот pJ в щелочной среде, у кислых – в кислой, у нейтральных – в нейтральной).
На кривой титрования изоэлектрическая точка соответствует точке перегиба и выражается половиной суммы значений рКа для карбокисльной и аминогуппы.
|
Задача 1. На основе строения аминокислот аланина, фенилаланина и валина предскажите какой изоэлектрической точкой они будут обладать. Рассчитайте их.
Задача 2. Каплю раствора, содержащего смесь лейцина, аспарагиновой кислоты и аргинина нанесли на полоску бумаги, предварительно смоченную буфером с рН 6,0, и концам полоски приложили электрическое напряжение. Какая аминокислота будет двигаться к аноду, к катоду и останется на старте?
Химические свойства аминокислот.
Реакция со спиртами, с образованием сложных эфиров:
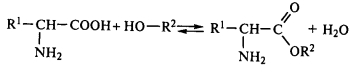
Реакция с кислотами, с образованием оксикислот (реакция Ван-Слайка):
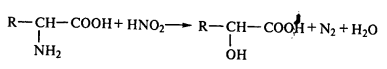
Реакция с формалином, используется для количественного определения аминокислот в молоке:
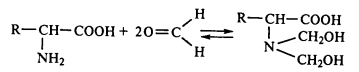
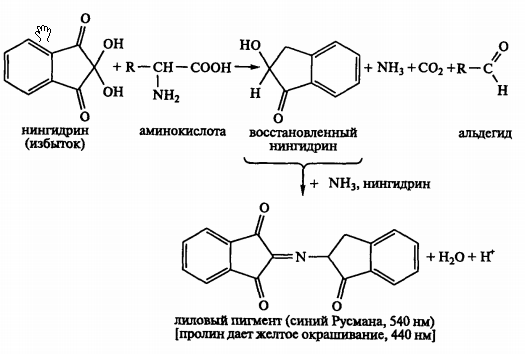
Реакция с нингидрином, используется для обнаружения и количественного определения аминокислот:
Реакция Майяра – реакция меланоидинообразования протекает при нагревании растворов аминокислот и редуцирующих сахаров с образованием меланоидинов, которые участвуют в формировании вкуса, запаха и цвета пищевых продуктов (корка испеченного хлеба, цвет кваса, пива, мясные изделия).
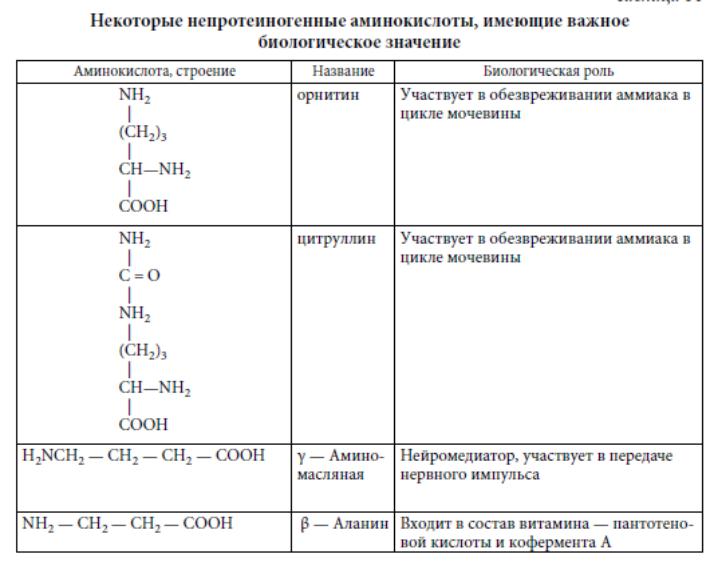
Непротеиногенные аминокислоты. К настоящему времени в различных объектах живого мира найдено около 200 различных аминокислот. В организме человека содержится около 60 различных аминокислот и их производных, но, как уже отмечалось, не все они участвуют в построении белковых молекул.
Аминокислоты, не участвующие в построении полипептидных цепей, получили название непротеиногенных. Они либо находятся в клетке в свободном виде (как продукты обмена), либо входят в состав других небелковых соединений. Ниже представлены некоторые из непротеиногенных аминокислот, имеющие важное био-логическое значение:
Вопрос 2. Полипептидную теорию строения белка разработал и экспериментально обосновал Э.Фишер. Разработав метод синтеза он установил, что аминокислоты в белках соединены пептидной связью (кислотноамидной):
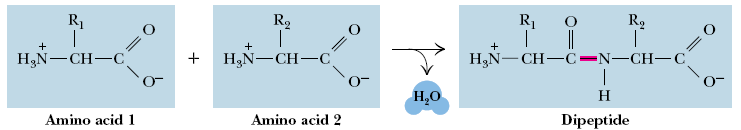
Особенности электроного строения предопределяют плоскую жесткую структуру пептидной группы.
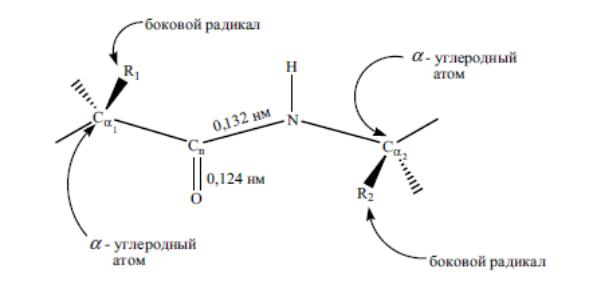
Полипептидные цепи различных белков отличаются друг от друга только лишь по характеру боковых радикалов, присоединенных к стержню. Короткие пептидные цепочки из 2-10 аминокислотных остатков – олигопептиды, от 10 до 20 – пептиды; от 20 до 50 полипептиды, свыше 50 – белки.
Принцип построения белковых молекул обеспечивает неисчерпаемое многообразие белковых структур. Из 20 различных аминокислот можно построить 20*20= 400 дипептидов или 20*20*20= 8000 трипептидов, а в общем случае 20n.
Задача 3. Рассчитайте сколько дипептидов может быть получено из пяти разных аминокислот, из пяти аминокислот, две из которых одинаковые и из семи, три из которых одинаковые?
При написании формулы линейных пептидов начинают с N-конца и указывают каждый остаток аминокислоты как ацильный заместитель аминогруппы следующего остатка. Названия аминокислотных остатков внутри, кроме С-конца пептидной цепи образуется от названия соответствующей аминокислоты путем замены её окончания на «ил». Например, дипептид состоящий от аланина и глицина:
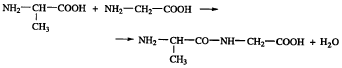
аланил-глицин
Задача 4. Изобразите полную структуру следующих пептидов и назовите их: мет-гли-глу-гис и фен-асп-фен-три.