
- •Методические указания
- •Содержание
- •Введение
- •Инструкция по работе с учебно-методическим пособием
- •В то же время основная форма обучения студента-заочника – это самостоятельная работа.
- •Программа дисциплины
- •Содержание курса
- •Тема 7. Оценка риска действия токсиканта. Процесс оценки риска. Идентификация опасности. Оценка токсичности. Оценка воздействия. Характеристика риска.
- •1 Основные понятия и термины токсикологии
- •Образец ответа Задание 1. Основные понятия и термины токсикологии
- •Вопрос 9 «Ксенобиотики»
- •2 Параметры и основные закономерности токсикометрии
- •Образец ответа Задание 2. Параметры и основные закономерности токсикометрии
- •Вопрос 9 «Транзиторные токсические реакции»
- •3 Биогенные элементы
- •Образец ответа Задание 3. Биогенные элементы
- •Вопрос 14 «Zn»
- •1S22s22p6 3s23p6 4s23d10– это d-элемент.
- •4 Биологическая роль элементов
- •Образец ответа Задание 4. Биологическая роль элементов
- •Вопрос 14 «Zn»
- •5 Токсикологическое значение элементов
- •Образец ответа Задание 5. Токсикологическое значение элементов
- •Вопрос 14 «Zn»
- •6 Нормирование качества окружающей природной среды. Санитарно-гигиеническое нормирование. Предельно допустимые и временно допустимые концентрации
- •Образец ответа Задание 6. Нормирование качества окружающей природной среды. Санитарно-гигиеническое нормирование. Предельно допустимые и временно допустимые концентрации
- •Вопрос 6 «Предельно допустимая нагрузка на окружающую
- •7 Специфика и механизм токсического действия вредных веществ. Воздействие химических веществ на популяции и экосистемы
- •Образец ответа Задание 7. Специфика и механизм токсического действия вредных веществ. Воздействие химических веществ на популяции и экосистемы.
- •Вопрос 1 «аммиак»
- •8 Краткая характеристика отдельных групп токсикантов
- •Образец ответа Задание 8. Краткая характеристика отдельных групп токсикантов
- •Вопрос 2 «Микотоксины»
- •9 Расчетные методы определения
- •Количественные характеристики токсикокинетики
- •Вопрос 4 «Биодоступность»
- •10 Оценка риска действия токсиканта
- •Образец ответа Задание 10. Оценка риска действия токсиканта
- •Вопрос 4 «Оценка воздействия»
- •11 Специфика воздействия радиоактивного излучения
- •Образец ответа Задание 11. Специфика воздействия радиоактивного излучения
- •Вопрос 8 «Популяционные реакции на радиационную обстановку»
- •12 Правовые и социальные нормы охраны окружающей среды
- •Образец ответа Задание 12. Правовые и социальные нормы охраны окружающей среды
- •Вопрос 8 «Перечислите нормативы качества охраны окружающей среды»
- •Вопросы для подготовки к экзамену
- •Список рекомендуемой литературы
- •Дополнительная литература
Образец ответа Задание 3. Биогенные элементы
(Приведите характеристику элемента: положение в таблице
Д. И. Менделеева, электронная формула, распространение в природе, источники поступления в организм, химические свойства)
Вопрос 14 «Zn»
цинк располагается в 4 периоде, 2-й группе побочной подгруппе.
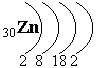
Электронная формула цинка:
1S22s22p6 3s23p6 4s23d10– это d-элемент.
электронно-графическая формула цинка:
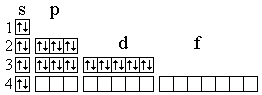
валентные возможности: 0 и II. Характерная степень окисления: +2.
Содержание цинка, масс. доля, % (по А. П. Виноградову) |
||||
Земная кора |
Почвы |
Морская вода |
Растения |
Животные |
5 . 10–3 |
5 . 10–3 |
5 . 10–6 |
3 . 10–4 |
1 . 10–3 |
Существуют различные классификации химических элементов, содержащихся в организме человека. Так, В. И. Вернадский в зависимости от среднего содержания (массовой доли , %) в живых организмах делил элементы по декадной системе.
Среднее содержание химических элементов в живом веществе
(по В. И. Вернадскому):
Декада |
Массовая доля , % |
Химические элементы |
IV |
10–2 –10–1 |
Mg, Fe, Na, Cl, Al, Zn |
Соответственно этой классификации элементы, содержащиеся в живых организмах, делят на три группы:
1. Макроэлементы. Это элементы, содержание которых в организме выше 10–2 %.
2. Микроэлементы. Это элементы, содержание которых в организме находится в пределах от 10–3 до 10–5 %.
3. Ультрамикроэлементы. Это элементы, содержание которых в организме ниже 10–5 %.
цинк относится к микроэлементам.
Потребность человека в цинке полностью удовлетворяется пищевыми продуктами: мясными, молочными, яйцами.
Металлы IIБ-группы реагируют при нагревании с галогенами (если без нагревания, то необходимо увлажнение), кислородом, серой. Цинк реагирует также с фосфором.
При взаимодействии с кислородом образуется оксид, имеющий характерную окраску: ZnO – белый. Оксид не растворяется в воде, но растворяются в кислотах.
Оксиду соответствует нерастворимый в воде амфотерный гидроксид Zn(ОН)2.
Zn(ОН)2
![]() ZnO
+ H2O
ZnO
+ H2O
Из соединений цинка в воде растворяются галогениды (кроме ZnF2), сульфаты, нитраты и некоторые другие. Многие из них растворяются также в органических растворителях.
При растворении соединений Zn в воде, а также при взаимодействии ЭО или Э(ОН)2 с кислотами образуются устойчивые аквакомплексы типа [Э(ОН2)4]2+ и [Э(ОН2)6]2+. Поэтому для Zn (II) характерны кристаллогидраты, например Zn(NO3)2.6H2O, ZnSO4.7H2О, Zn(BrO3)2.6H2O. Из других катионных комплексов наиболее устойчивы амминокомплексы типа [Э(NH3)4]2+ и [Э(NH3)6]2+, легко образующиеся действием аммиака на растворы солей:
ZnSO4 + 4NH3 = [Zn(NH3)4]SO4
Образованием аммиакатов объясняется легкая растворимость Э(ОН)2 в присутствии аммиака:
Zn(OH)2+ 6NH3 = [Zn(NH3)6](OH)2
Цинк образует различного рода цинкаты. Так, Zn(OH)2 легко растворяется в щелочах за счет образования растворимых гидроксоцинкатов:
Zn(OH)2 + 2KOH = K2[Zn(OH)4]
Амфотерный характер Zn(OH)2 и его поведение в кислых и щелочных растворах можно отразить следующей схемой:
![]()
Аналогичным образом ведет себя в жидком аммиаке амид (дигидро-нитрид) цинка Zn(NH2)2. Подобно тому как Zn(OH)2 не растворяется в воде, Zn(NH2)2 не растворяется в жидком аммиаке, но легко растворяется в присутствии аммонокислот и аммонооснований:

При избытке ионов NH4+ образуются аммиакаты, при избытке ионов NH2– – дигидронитридоцинкаты (амидоцинкаты).
Наиболее прочны комплексы с -акцепторными лигандами CN– типа [Э(CN)4]2–, которые легко образуются при действии на растворы солей Э (II) основного цианида. Образующиеся вначале осадки Zn(CN)2 в избытке основного цианида растворяются:
2KCN + Zn(СN)2 = K2[Zn(CN)4]
