
- •Раздел 1. Источники энергии при сварке
- •1.1. Физические основы и определение процесса сварки
- •1.2. Особенности формирования сварного соединения
- •1.3. Классификация процессов сварки
- •1.4. Требования к источникам энергии при сварке и оценка
- •1.5. Электрическая дуга как вид электрического разряда
- •1.6. Особенности электрической проводимости твердых тел,
- •1.7. Способы возбуждения сварочной дуги и ее зоны.
- •1.8. Общие законы образования заряженных частиц в газе
- •1.8.1. Ионизация газов
- •1.8.2. Фотоионизация
- •1.8.3. Ионизация соударением частиц
- •1.8.4. Термическая ионизация
- •1.8.5. Ионизация частиц в результате их ускорения
- •1.8.6. Эмиссионные процессы на поверхности твердых тел
- •1.8.7. Термоэлектронная эмиссия
- •1.8.8. Автоэлектронная эмиссия
- •1.8.9. Фотоэлектронная эмиссия
- •1.8.10. Вторичная эмиссия
- •1.9. Приэлектродные области дугового разряда
- •1.9.1. Катодная область
- •1.9.2. Анодная область
- •1.9.3. Столб дуги
- •1.10. Характеристика переноса электродного металла
- •1.10.1. Силы тяжести и поверхностного натяжения
- •1.10.2. Электродинамическая сила (пинч-эффект)
- •1.10.3. Реактивное давление, обусловленное интенсивным
- •1.10.4. Электростатические силы
- •1.10.5. Плазменные потоки
- •1.10.6. Влияние напряжения дуги на перенос металла
- •1.11. Устойчивость дугового разряда
- •1.12. Магнитная гидродинамика сварочной дуги
- •1.12.1. Собственное поле дуги и контура сварки
- •1.12.2. Внешнее магнитное поле и дуга
- •1.12.3. Практическое использование влияния на дугу поперечного магнитного поля
- •3. Вращающаяся (бегущая) дуга
- •1.13. Плазменнодуговые процессы
- •1.14. Лучевые источники энергии при сварке
- •1.14.1. Электроннолучевые источники
- •1.14.2. Фотоннолучевые источники
- •Раздел 2. Основы физической химии
- •2.2. Первое начало термодинамики и его следствия
- •2.3. Вычисление теплоемкостей веществ
- •2.4. Второе начало термодинамики
- •2.5. Понятие об изотермных потенциалах
- •2.6. Равновесие физико-химических систем
- •2.6.1. Закон действующих масс и константа равновесия
- •2.6.2. Закон действующих масс и константа равновесия
- •2.7. Максимальная работа реакции и ее связь
- •2.8. Влияние температуры и давления на
- •2.8.1. Влияние температуры на положение равновесия
- •2.8.2. Влияние давления на положение равновесия
- •2.8.3. Вычисление констант равновесия химических
- •2.9. Явления в жидких средах и на поверхностях
- •2.9.1. Закон распределения вещества в несмешивающихся
- •2.9.2. Практическая ценность закона распределения при изучении металлургических процессов
- •2.9.3. Поверхностная энергия
- •2.9.4. Адсорбция
- •2.9.5. Вязкость жидкости
- •2.9.6. Процессы испарения
- •2.10. Оценка химического сродства элементов к кислороду
- •2.10.1. Оценка степени сродства элементов к кислороду по изменению изобарно-изотермного потенциала образования окисла
- •2.10.2. Оценка степени химического сродства элементов к кислороду
- •2.10.3. Упругость диссоциации компонентов, находящихся в
- •Раздел III. Металлургические основы сварки плавлением
- •Радел IV. Основы тепловых процессов при сварке
- •Основные теплофизические единицы, понятия и определения
- •Дифференциальные уравнения теплопроводности
- •Стационарный процесс распространения теплоты
- •Теплоты при сварке
- •Мгновенный точечный источник теплоты в полубесконечном теле
- •Мгновенный линейный источник теплоты в пластине
- •Мгновенный плоский источник теплоты в стержне
- •Сварочные источники теплоты
- •Непрерывно действующие неподвижные источники теплоты
- •Непрерывно действующий неподвижный точечный источник теплоты на поверхности полубесконечного тела
- •Непрерывно действующий неподвижный линейный источник теплоты в пластине
- •Непрерывно действующий неподвижный плоский источник теплоты в стержне
- •Подвижные сосредоточенные источники теплоты
- •Подвижный точечный источник теплоты на поверхности полубесконечного тела
- •Мощные быстродвижущиеся источники теплоты
- •Расчеты термического цикла основного металла
- •Наплавка валика на массивное тело
- •Однопроходная сварка листов встык
- •Валиковая проба
- •Производительность дуговой сварки
- •Расплавление электрода
- •Проплавление основного металла
- •Определение времени пребывания металла сварочной ванны в расплавленном состоянии и длины сварочной ванны
- •2. Определение площади проплавления основного металла
- •3. Определение ширины зоны нагрева
- •Тепловая эффективность процесса сварки
- •Раздел V. Технологическая прочность сварных соединений Понятие технологической и эксплуатационной прочности
- •Трещины при сварке и их классификация
- •Горячие трещины при сварке
- •Методика оценки склонности металла сварного шва к образованию горячих трещин
- •Влияние различных факторов на вероятность образования горячих трещин
- •Холодные трещины при сварке
- •Методы определения стойкости металла околошовной зоны против образования холодных трещин
- •Методы определения стойкости против перехода в хрупкое состояние
- •Методы проверки эксплуатационных характеристик металла шва, околошовной зоны и сварного соединения
- •Пути повышения технологической прочности сварных соединений
- •Раздел VI. Свариваемость металлов Понятие свариваемости металлов. Факторы, определяющие свариваемость металлов
- •Влияние изменения химического состава на свариваемость
- •Ориентировочная оценка свариваемости стали по эквивалентному содержанию углерода
- •Характеристика свариваемости сталей
- •I. Свариваемость углеродистых конструкционных сталей
- •2. Свариваемость легированных сталей
- •2.1. Свариваемость низколегированных сталей
- •2.2. Свариваемость среднелегированных сталей
- •2.3. Свариваемость высоколегированных сталей
- •2.3.1. Свариваемость высоколегированной стали мартенситного класса
- •2.3.2. Свариваемость высоколегированной стали ферритного класса
- •2.3.3. Свариваемость высоколегированной стали аустенитного класса
- •2.3.4.Свариваемость высоколегированной стали карбидного класс
2.8. Влияние температуры и давления на
положение равновесия
2.8.1. Влияние температуры на положение равновесия
Выяснить
влияние температуры на положение
равновесия (величину константы равновесия)
можно, решая совместно уравнение изотермы
Вант-Гоффа
![]()
и уравнение
Гиббса-Гельмгольца
![]()
Продифференцируем уравнение изотермы по температуре как по неза-висимой переменной, считая объем постоянным.
![]() Умножим на Т
Умножим на Т
![]()
Заменим
![]() работой А
и в полученное выражение подставим
зна-чение работы из уравнения
Гиббса-Гельмгольца. После необходимых
со-кращений получим
работой А
и в полученное выражение подставим
зна-чение работы из уравнения
Гиббса-Гельмгольца. После необходимых
со-кращений получим
![]() Разделим на
RT2
Разделим на
RT2
![]()
В зависимости от условий, в которых протекает реакция, можно полу-чить уравнения изохоры или изобары реакции Вант-Гоффа:
а) для изохорного
процесса
![]()
![]() —
уравнение изохоры
(2.30)
—
уравнение изохоры
(2.30)
б) для изобарного
процесса
![]() .
.
![]() —
уравнение изобары
(2.31)
—
уравнение изобары
(2.31)
Из уравнения изобары реакции Вант-Гоффа можно сделать вывод о влиянии температуры на положение равновесия, для чего рассмотрим примеры.
1. Выполняется процесс атомно-водородной сварки
![]()
Процесс
эндотермический, так как диссоциация
молекулярного водо-рода сопровождается
поглощением теплоты, т. е.
![]() Следовательно,
Следовательно,
![]()
Константа равновесия
реакции равна
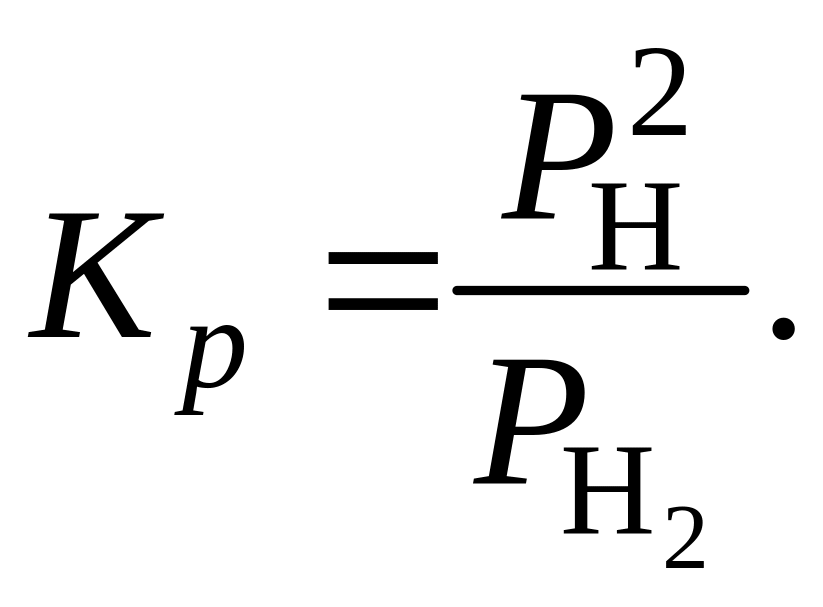
С повышением температуры логарифм константы равновесия или просто константа равновесия растет, т. е. с повышением температуры реакция сме-щается в сторону увеличения концентрации или парциальных давлений конечных продуктов.
2. Получение углекислого газа на углекислотной станции ОАО Рост-сельмаш из отходящих дымовых газов ТЭЦ.
![]()
Реакция
образования углекислого газа
экзотермическая, так как сопро-вождается
выделением теплоты, т. е.
![]() Следовательно,
Следовательно,
![]()
Константа равновесия реакции равна

В этом случае с повышением температуры логарифм константы равно-весия или просто константа равновесия уменьшается, т. е. с повышением температуры реакция смещается в сторону увеличения концентрации или парциальных давлений начальных продуктов.
2.8.2. Влияние давления на положение равновесия
Если реакция протекает без изменения числа молекул, то давление не влияет на положение равновесия. Если реакция протекает с изменением числа молекул, то давление влияет на положение равновесия. При этом на-блюдаются следующие закономерности:
а) при увеличении давления исходных продуктов равновесие смещается в сторону уменьшения числа молекул;
б) при уменьшении давления исходных продуктов равновесие смещается в сторону увеличения числа молекул.
Все сказанное о влиянии температуры и давления на положение равно-весия обобщается принципом JIe-Шателье — Брауна: всякая система нахо-дится в равновесии и при внешнем воздействии стремится перейти в состо-яние, при котором это воздействие ослабляется.
Поскольку процессы сварки обычно протекают в условиях постоянства давления, то наибольшее влияние на смещение равновесия оказывает тем-пература.
