
- •Предмет технической термодинамике и ее методы.
- •2.Основные понятия технической термодинамики. Характерные представители рабочих тел.
- •3.Термические параметры состояния состояние рабочего тела ( абсолютная температура, удельный объем, абсолютная давление)
- •4. Понятие идеального газа и реального газа. Уравнение состояния.
- •5 Теплота и работа как форма передачи энергии. Графическое определение теплоты и работы в координатах t-s, p-V.
- •7. Первый закон термодинамики в общем виде для закрытой термомеханической системы. Его аналитическое выражение и основные формулировки.
- •8. Первый закон термодинамики для изохорного , адиабатного и изотермического процессов.
- •9. Массовая объемная и мольная теплоемкость, взаимосвязь между ними.
- •10Зависимость теплоемкости от температуры. Определение средней теплоемкости идеальных газов.
- •11Зависимость теплоемкости от характера процесса. Уравнение Майера для идеального газа.
- •12. Основные определения и понятия газовой смеси. Теплоемкость смеси газов.
- •13. Общие свойства газовой смеси. Модификатор газовой смеси.
- •14. Сущность основные формулировки второго закона термодинамики и его аналитическое выражение.
- •15. Прямые и обратные циклы Карно, термический кпд и холодильный коэффициент циклов.
- •16 Понятие и физическая сущность энтропии.
- •17. Уравнение политропного процесса. Показатель поли тропы изохорного, изотермического, изобарного и адиабатного процессов, их уравнение.
- •19. Дать определение водяного пара в различных его состояниях.
- •20. Диаграмма h-s процессы водяного пара.
- •21. Истечение газов и паров. Понятие о сопловом и диффузорном течении газа. Уравнение первого закона термодинамики для потока.
- •22. Дросселирование газов и паров, сущность процесса, процесс дросселирования в h-s диаграмме, практическое использование процесса дросселирования.
- •23. Основные положения теплопроводности, понятие изотермической поверхности, градиента температур. Основной закон теплопроводности- Закон Фурье.
- •24 . Теплопроводность при стационарном режиме. Теплопроводность однослойной и многослойной стенки. График изменения температур в однослойной и многослойной стенках.
- •25. Основы теории конвективного теплообмена. Физическая сущность конвективного теплообмена. Основной закон конвективного теплообмена.
- •26. Определения коэффициента теплоотдачи. Критерии подобия. Уравнение подобия для свободного движения теплоносителя в общем виде.
- •27 . Основы теории теплообмена излучением. Определение теплообмена излучением. Закон Стефана- Больцмана. Коэффициенты поглощения, отражения, пропускания.
- •28. Закон Стефана-Больцмана. Теплообмен излучением между двумя плоскими параллельными поверхностями. Приведенная степень чистоты системы тел.
- •29. Теплопередача. Понятия коэффициента теплопередачи, термического сопротивления теплопередачи, температурного напора. Уравнение теплопередачи.
- •30 Основы теплового расчета теплообменника с прямоточной и противоточной схемой движения носителя.
- •31 Характеристика топлива (высшая и низшая теплота сгорания, элементарный состав, выход летучих горючих).
- •32.Расход топлива для котельной предприятия. Влияние характеристик производимого пара на расход топлива. Условное топливо.
- •33. Назначение и классификация паровых котлов , используемых на предприятиях отрасли.
- •34. Устройство и принцип действия паровых котлов.
- •35. Назначение и принцип действия основных элементов парового котла.
- •36. Назначение и принцип действия вспомогательного оборудования котельной установки.
- •37. Тепловой баланс котельной установки. Составляющие уравнения теплового баланса.
- •38.Полезноиспользуемая теплота. Коэффициент полезного действия котла по прямому и обратному балансам.
- •39. Дать физическую интерпретацию потерь теплоты с уходящими газами и химическим недожогом.
- •40. Принципы обеспечения безопасности работы паровых котлов.
- •41. Схемы теплоснабжения предприятий отрасли. Основные теплоносители, используемые на предприятии, их характеристики.
- •42. Что такое холодильная техника и холодильная технология. Основы холодильной обработки и хранения продуктов.
- •43. Физические принципы получения низких температур.
- •49. Способы охлаждения камер хранения.
- •50. Характеристика и свойства холодильных агентов.
8. Первый закон термодинамики для изохорного , адиабатного и изотермического процессов.
При изохорном процессе объем газа остается постоянным, поэтому газ не совершает работу. Изменение внутренней энергии газа происходит благодаря теплообмену с окружающими телами:
![]()
При изотермическом процессе количество теплоты, переданное газу от нагревателя, полностью расходуется на совершение работы:
![]()
При изобарном расширении газа подведенное к нему количество теплоты расходуется как на увеличение его внутренней энергии и на совершение работы газом:
![]()
Адиабатный процесс - термодинамический процесс в теплоизолированной системе.
![]()
9. Массовая объемная и мольная теплоемкость, взаимосвязь между ними.
Массовая теплоёмкость (С) — это количество теплоты, которое необходимо подвести к единице массы вещества, чтобы нагреть его на единицу температуры. В СИ измеряется в джоулях на килограмм на кельвин (Дж·кг−1·К−1). 1 ккал=4,2 кДж
Объёмная теплоёмкость (С′) — это количество теплоты, которое необходимо подвести к единице объёма вещества, чтобы нагреть его на единицу температуры. В СИ измеряется в джоулях на кубический метр на кельвин (Дж·м−3·К−1).
Молярная теплоёмкость (Сμ) — это количество теплоты, которое необходимо подвести к 1 молю вещества, чтобы нагреть его на единицу температуры. В СИ измеряется в джоулях на моль на кельвин (Дж/(моль·К)).
10Зависимость теплоемкости от температуры. Определение средней теплоемкости идеальных газов.
зависимость теплоемкости от температуры - уникальное физическое свойство каждого индивидуального вещества, его фундаментальная характеристика. При низких температурах (порядка 10 К) в твердых веществах с металлической связью основной вклад в теплоемкость вносят свободные электроны, теплоемкость которых пропорциональна температуре. Очевидно, что электронной составляющей теплоемкости для проведения расчетов металлургических процессов можно пренебречь.
При высоких температурах близких к температуре плавления вещества существенным (порядка 10 %) становится вакансионный вклад в теплоемкость. Этот вклад достаточно просто можно оценить, если известна температурная зависимость концентрации вакансий
Средняя теплоемкость определяет среднее количество подведенной теплоты при нагревании единицы количества газа на 1° в интервале температур от tx до t%: где q - количество теплоты, подведенной к единице массы газа при его нагревании от температуры tt до температуры t%.
11Зависимость теплоемкости от характера процесса. Уравнение Майера для идеального газа.
МАЙЕРА
УРАВНЕНИЕ-
ур-ние, устанавливающее связь между
теплоёмкостями при пост, давлении Cp и
пост, объёме С V 1
кмоля идеального
газа:![]() где R- газовая
постоянная.Впервые
было получено Ю. P. Майером . Для произвольной
массы т (кг)
вещества в состоянии идеального газа
M. у. записывается в виде:
где R- газовая
постоянная.Впервые
было получено Ю. P. Майером . Для произвольной
массы т (кг)
вещества в состоянии идеального газа
M. у. записывается в виде: ![]() ,
где
,
где ![]() -
молекулярная масса газа. M. у. можно
получить из общего соотношения
-
молекулярная масса газа. M. у. можно
получить из общего соотношения ![]() , если
учесть, что для идеального газа
справедливоКлапейрона
уравнение.
, если
учесть, что для идеального газа
справедливоКлапейрона
уравнение.
12. Основные определения и понятия газовой смеси. Теплоемкость смеси газов.
Газовой смесью понимается смесь отдельных газов, вступающих между собой ни в какие химические реакции. Каждый газ (компонент) в смеси независимо от других газов полностью сохраняет все свои свойства и ведет себя так, как если бы он один занимал весь объем смеси.
1.Полная теплоемкость смеси газов представляет собой сумму теплоемкостей газов, составляющих смесь:
![]()
2. Удельная массовая теплоемкость смеси газов равна сумме произведений массовых долей на удельные массовые теплоемкости газов, составляющих смесь:
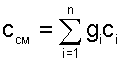
3. Удельная объемная теплоемкость смеси газов:
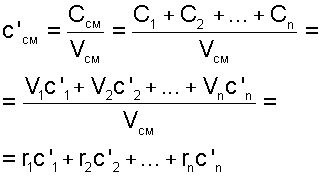
4. Использование парциальных объемов правомерно, поскольку они соответствуют массовому количеству каждого газа, входящему в смесь, т.е. количество теплоты можно представить выражением:
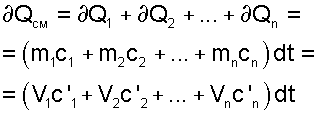
5. Удельная объемная теплоемкость смеси газов равна сумме произведений объемных долей на удельные объемные теплоемкости газов, составляющих смесь
6. Удельную мольную теплоемкость смеси газов можно получить умножив выражение (4.81) на объем одного киломоля, поскольку по закону Авогадро объем киломоля всех идеальных газов при одинаковых параметрах одинаков Vμcм=Vμ1=Vμ2=···=Vμn
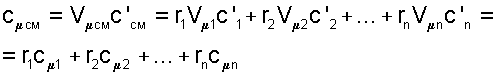
7. Получили, что удельная мольная теплоемкость смеси газов равна сумме произведений объемных долей на удельные мольные теплоемкости газов, составляющих смесь:

