
- •1.)Гомогенная и гетерогенная система.Фаза,компонент.Факторы,влияющие на скорость химической реакции.
- •2.)Средняя и мгновенная скорость химической реакции.Факторы,влияющие на скорость в гомогенной и гетерогенной системах.
- •3.)Зависимость скорости зимической реакции от концентрации реагирующих веществ в гомогенной и гетерогенной системах.Примеры.
- •4.)Зависимость скорости химической реакции от температуры.Уравнение Вант-Гоффа.
- •5.)Активные и неактивные молекулы.Энергия активации.Единицы измерения.
- •6.)Обратимые и необратимые процессы.Кинетика обратимого процесса.Привести примеры.
- •7.)Состояние химического равновесия.Константа равновесия.Привести пример.Какие факторы влияют на константу равновесия.
- •8,9)Смещение химического равновесия.Принцип Ле-Шателье.
- •10.)Энергетические эффекты химической реакции.Первый хакон термодинамики.
- •12.)Энтальпия.Стандартные условия при определении энтальпии.Каким образом рассчитывается.
- •13.Закон Гесса.Привести пример определения энтальпии химической реакции.
- •14.Понятие об энтропии.Как связано понятие энтропии с изменением объёма системы.
- •15.Движущая сила химической реакции.Энергия Гиббса.Определение температуры равновесия.
- •16.)Способы выражения концентраций растворов.
- •17.)Понятие об эквиваленте.Закон эквивалентов.Нормальная с.Определение эквивалента соли,оксида,кислоты,основания.
- •18.Теория электролитической диссоциации.
- •19.Кислоты,основания,соли.Процессы диссоциации.Основные свойства.
- •20.)Степень диссоциации.Сильные и слабые электролиты.
- •21.)Ионное произведение воды.Водородный показатель.
- •22.)Гидролиз солей.Факторы,влияющие на процессы гидролиза соли.
- •23.)Растворимость.Насыщенные и пересыщенные растворы.
- •24.)Произведение растворимости.
- •25.)Давление насыщенного пара.Закон Рауля.Определение температуры кипения и кристаллизации раствора.Эбуллиоскопические и криоскопические константы.
- •26.)Отклонение от закона Рауля для растворов электролитов.Изотонический эффект.
- •27.)Временная и постоянная жесткость воды.Единицы измерения жесткости.Устранение временной и постоянной жесткости воды.Иониты.
- •28.)Окислительно-восстановительные реакции. Степень окисления.Важнейшие окислители и восстановители.
- •29.)Типы окислительно-восстановительных реакций.Привести примеры.
- •30.)Механизм возникновения электродного потенциала.
- •31.)Гальванические элементы.Принцип работы.Эдс элемента.
- •32.)Гальванический элемент Якоби и Вольта.
- •33.)Стандартный (водородный) электрод.Определение стандартного электродного потенциала металла.
- •34.)Ряд напряжений металлов и выводы из него.
- •35.)Концентрационные гальванические элементы.Уравнение Нернста.
- •36.)Электронные процессы на электродах при электролизе.Электролиз расплава соли.
- •37.)Электролиз водного раствора соли.
- •38.)Законы Фарадея.Применение процессов электролиза.
- •39.)Виды коррозионных разрушений.
- •40.)Классификация коррозионных процессов.Химическая и электрохимическая коррозия.
- •42.)Методы защиты металлов от коррозии.
1.)Гомогенная и гетерогенная система.Фаза,компонент.Факторы,влияющие на скорость химической реакции.
1.Фаза – часть системы,однородная по составу и строению и отделённая от других частей системы границей раздела.(Вода + таящий лёд)
2.Компонент – это составная часть системы. (компоненты воздуха:кислород,азот,СО2,ргон)
Гетерогенная сиситема не имеет поверхности раздела,а гомогенная имеет (Na+H20)
3.Основные факторы:концентрация реагентов,температура,катализаторы.
2.)Средняя и мгновенная скорость химической реакции.Факторы,влияющие на скорость в гомогенной и гетерогенной системах.
Скорость реакции пропорциональна вероятности столкновения частиц,а вероятность определяется их концентрацией.V = kCaCb. Если реакция гетерогенная,то вещества в тв.форме не учитываются.Fe3O4+4H2 => 3Fe+4H2O; V= k[H2]^4
Т.е. скорость реакции зависит только от концентрации газообразных веществ.
1.Ср.v – изменение концентрации вещества за данный промежуток Vср=(C2-C1)/(t2 – t1)
2.Мгновенная скорость – скорость в данный момент времени V = dc/dt.3.Факторы,влияющие на V гомогенной реакции.1 Природа реагентов 2 концентрация 3 температура 4 катализатор
4.Фак.на гетер.реакцию 1 Зависит от площади поверхности раздела фаз 2 Скорость подвода реагентов к границе 3скорость отвода продуктов
3.)Зависимость скорости зимической реакции от концентрации реагирующих веществ в гомогенной и гетерогенной системах.Примеры.
1.В гомогенных реакциях реагенты находятся в одной фазе,равномерно перемешаны между собой,реакция идёт по всему объёму смеси.
2.Закон действия масс: 1.Для гомогенных:
2SO2+O2 2SO3;V=k[SO2}^2[O2]
2.Для гетерогенных:
Fe3O4 + 4H2 3Fe + 4H2O V = k[H2]^4
4.)Зависимость скорости химической реакции от температуры.Уравнение Вант-Гоффа.
1.Правило:при повышении температуры на 10 , V реакции возрастает в 2-4 раза.
(Гамма
= V(t+10)/V(t)
= 2-4 (Температурный коэффицент). Таким
образом,если температура возрастает
на дельта тэ,то скорость реакции
возрастает в след. Кол-во раз: Vкон./Vисх
=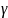
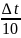
5.)Активные и неактивные молекулы.Энергия активации.Единицы измерения.
1.Увеличение скорости реакции с повышением температуры объясняется не увеличением числа столкновений частиц,а увеличением числа соударений активных молекул,т.е. молекул,обладающих запасом энергии достаточным если не для полного разрыва связи,то,по крайней мере,для их максимального ослабления.Эта минимальная энергия,необходимая для осуществления акта химического взаимодействия,называется энергией активации Ea.При повышении температуры число молекул,обладающих е больше еа,возрастает в геометрической прогрессиии.
2.Правило Вант-Гоффа выполняется для реакций с еа = 84-170 кДж/моль.Сейчас показано,что еа химических реакций колеблется40-400кДж/моль
