
- •13. Распределение Больцмана
- •14. Внутренняя энергия. Теплота и работа. Работа газа при расширении.
- •15. 1 Закон термодинамики и его применение к изопроцессам
- •Частные случаи первого закона термодинамики для изопроцессов
- •Цикл Карно для тепловой машины
- •16. Понятие о равновесных и неравновесных процессах.
- •Если две системы находятся в состоянии теплового равновесия с третьей системой, то они пребывают в состоянии теплового равновесия и друг с другом.
15. 1 Закон термодинамики и его применение к изопроцессам
Первый закон термодинамики (закон сохранения энергии для тепловых процессов) определяет количественное соотношение между изменением внутренней энергии системы дельта U, количеством теплоты Q, подведенным к ней, и суммарной работой внешних сил A, действующих на систему.
Первый закон термодинамики - Изменение внутренней энергии системы при ее переходе из одного состояния в другое равно сумме количества теплоты, подведенного к системе извне, и работы внешних сил, действующих на нее:
![]()
Первый закон термодинамики - количество теплоты, подведенное к системе, идет на изменение ее внутренней энергии и на совершение системой работы над внешними телами:
![]()
Частные случаи первого закона термодинамики для изопроцессов
При изохорном процессе объем газа остается постоянным, поэтому газ не совершает работу. Изменение внутренней энергии газа происходит благодаря теплообмену с окружающими телами:
![]()
При изотермическом процессе количество теплоты, переданное газу от нагревателя, полностью расходуется на совершение работы:
![]()
При изобарном расширении газа подведенное к нему количество теплоты расходуется как на увеличение его внутренней энергии и на совершение работы газом:
![]()
Адиабатный процесс - термодинамический процесс в теплоизолированной системе.
![]()
Теплоизолированная система - система, не обменивающаяся энергией с окружающими телами.
Формула КПД теплового
двигателя:
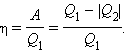 Здесь
Q1 -
количество теплоты, полученное рабочим
телом,
Q2 -
количество теплоты, отданное холодильнику.
A
- полезная работа.
Формула
Карно для оценки
максимального КПД теплового
двигателя:
Здесь
Q1 -
количество теплоты, полученное рабочим
телом,
Q2 -
количество теплоты, отданное холодильнику.
A
- полезная работа.
Формула
Карно для оценки
максимального КПД теплового
двигателя:
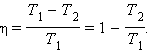 T1 -
температура нагревателя, T2 -
температура холодильника.
T1 -
температура нагревателя, T2 -
температура холодильника.
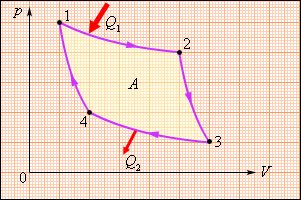
Цикл Карно для тепловой машины

Энергетическая схема тепловой машины: 1 – нагреватель; 2 – холодильник; 3 – рабочее тело, совершающее круговой процесс. Q1 > 0, A > 0, Q2 < 0; T1 > T2
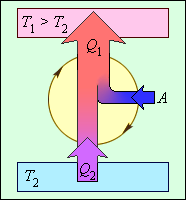
Энергетическая схема холодильной машины. Q1 < 0, A < 0, Q2 > 0, T1 > T2
16. Понятие о равновесных и неравновесных процессах.
Совокупность тел любой физической природы и любого химического состава, характеризуемая некоторым числом макроскопических параметров, называется термодинамической системой. Для описания состояния простейшей термодинамической системы необходимо знать ее температуру t, объем V и давление р, так называемые термодинамические (макроскопические) параметры.
Опыт показывает, что система, предоставленная самой себе, по прошествии некоторого промежутка времени приходит в состояние, в котором каждый параметр имеет одинаковое значение во всех точках системы и остается неизменным с течением времени. Такое состояние называется равновесным или состоянием термодинамического равновесия.
Возможны и такие состояния системы, в которых какой-либо из параметров имеет неодинаковые значения в ее различных точках, т.е. не существует единого значения данного параметра для всей системы. В этом случае равновесие еще не установилось, и такое состояние называется неравновесным.
При переходе термодинамической системы из одного равновесного состояния в другое ее параметры изменяются. Изменение параметров состояния системы с течением времени называется процессом. Процесс установления в термодинамической системе равновесного состояния называется релаксацией, а соответствующее время — временем релаксации.
Таким образом, термодинамика — раздел физики, изучающий наиболее общие свойства макроскопических систем, находящихся в состоянии термодинамического равновесия, и процессы перехода между этими состояниями.
Пусть систему, находящуюся в равновесном состоянии А, нужно перевести в равновесное состояние В, например, нагреть газ в колбе от одной температуры до другой. Если процесс происходит с такой скоростью, что значения параметров системы будут успевать выравниваться по всему объему, то его называют равновесным (квазистатическим). Иными словами, равновесный процесс должен идти настолько медленно, чтобы все промежуточные состояния системы были равновесными.
Термодинамический процесс называется обратимым, если систему можно вернуть из состояния В в состояние А через те же промежуточные равновесные состояния, но только в обратном порядке.
Параметры, описывающие состояние системы, являются взаимозависимыми. Например, если при постоянной температуре увеличивать давление газа, то его объем будет уменьшаться. Следовательно, между параметрами системы (р, V, t) существует определенная связь, которая задается уравнением состояния.
Для определения термодинамического равновесия необходим параметр, не встречавшийся в механике,— температура.
Температура — скалярная физическая величина, характеризующая состояние термодинамического равновесия макроскопической системы. Она определяет не только степень нагретости, но и способность системы находиться в термодинамическом равновесии с другими системами.
Для нахождения температуры используют легко измеряемые физические параметры, зависящие от степени нагретости тела — термометрические параметры. Такими параметрами являются, например, давление газа в сосуде с неизменным объемом, высота столбика жидкости в стеклянной трубке, сопротивление проводника. Измерение любого такого параметра может использоваться для создания термометра. В силу различных физических причин каждый термометр имеет ограниченную область применения. Например, работа газового термометра ограничена температурой конденсации газа, работа ртутного термометра — температурой затвердевания (—39 °С) и кипения (357 °С) ртути. Подчеркнем, что внутри рабочего диапазона ртуть является хорошим термометрическим веществом, так как ее объем линейно увеличивается при увеличении температуры.
В настоящее время на практике используются температурные шкалы Цельсия и Фаренгейта. В СИ используется абсолютная термодинамическая шкала температур, которую в 1848 г. предложил английский физик Уильям Томсон. Поскольку за работы в области физики он был удостоен титула лорда Кельвина, то эту шкалу называют шкалой Кельвина.
Отметим, что температура определяется только для системы, находящейся в состоянии термодинамического равновесия.
Если системы А и В, В и С находятся я тепловом равновесии, то и системы А и С также находятся в тепловом равновесии между собой. Пусть состояния каждой из систем A, B, C характеризуется давлением p и объемом V. В случае теплового равновесия между двумя системами объем и давление одной системы связаны с объемом и давлением другой системы следующим образом:
fa(pa, Va) – fb(pb, Vb)=0
fc(pc, Vc) – fb(pb, Vb)=0
Если теперь одну из систем, например B, использовать как термометр, то значение функции fb(pb, Vb)=Θ можно рассматривать как эмпирическую температуру. Сами же уравнения
fa(pa, Va) =fb(pb, Vb)= fc(pc, Vc)= Θ
называется уравнением состояния
Исходя из вышеприведенного, сформулируем нулевое начало термодинамики, которое было так названо по предложению английского физика Ральфа фаулера:
