- •Ю. В. Ліцман, л. І. Марченко, с. Ю. Лебедєв Самостійна робота студентів при вивченні Хімії
- •Самостійна робота студентів при вивченні Хімії
- •Самостійна робота студентів при вивченні Хімії
- •Розділ 1 підготовка до опрацювання теоретичного матеріалу
- •Основні поняття та стехіометричні закони хімії
- •Результати вивчення розділу
- •Література для підготовки теоретичного матеріалу
- •План вивчення розділу
- •Приклади розв’язання типових задач і виконання завдань до розділу Основні поняття та стехіометричні закони хімії
- •Завдання для самоперевірки
- •Основи теорії будови речовини
- •Результати вивчення розділу
- •Література для підготовки теоретичного матеріалу
- •План вивчення теми
- •Приклади виконання типових завдань
- •Завдання для самоперевірки
- •Комплексні сполуки
- •Результати вивчення розділу
- •Література для підготовки теоретичного матеріалу
- •План вивчення розділу
- •Приклади виконання типових завдань
- •Завдання для самоперевірки
- •Основні закономірності перебігу хімічних реакцій
- •Результати вивчення теми
- •Література для підготовки теоретичного матеріалу
- •Приклади розв’язання типових задач і виконання завдань
- •Властивості розчинів і йонообмінні реакції в розчинах електролітів
- •Результати вивчення розділу
- •Література для підготовки теоретичного матеріалу
- •План вивчення розділу
- •Приклади розв’язання типових задач і виконання завдань
- •Завдання для самоперевірки
- •Окисно-відновні реакції та електрохімічні процеси
- •Результати вивчення розділу
- •Література для підготовки теоретичного матеріалу
- •План вивчення розділу
- •Приклади розв’язання типових задач і виконання завдань
- •Завдання для самоперевірки
- •1.7 Огляд елементів - металів
- •Результати вивчення розділу
- •Література для підготовки теоретичного матеріалу
- •План вивчення розділу
- •Приклади розв’язання типових задач і виконання завдань
- •1.8 Характеристика елементів - неметалів ivа-групи
- •Результати вивчення розділу
- •Література для підготовки теоретичного матеріалу
- •План вивчення розділу
- •Приклади розв’язання типових задач і виконання завдань
- •1.9 Основи знань про органічні сполуки і полімерні матеріали
- •Результати вивчення розділу
- •Розділ 2 підготовка до практичних занять
- •2.1 Практичне заняття 1 Основні закони хімії
- •Підготовка до заняття
- •Запитання до практичного заняття
- •2.2 Практичне заняття 2 Будова електронних оболонок атома
- •Підготовка до заняття
- •Запитання до практичного заняття
- •Завдання
- •2.3 Практичне заняття 3 Періодичний закон і електронна природа атомів
- •Підготовка до заняття
- •Запитання до практичного заняття
- •Завдання
- •2.4 Практичне заняття 4 Ковалентний зв’язок. Метод валентних зв’язків (мвз)
- •Підготовка до заняття
- •Запитання до практичного заняття
- •Завдання
- •2.5 Практичне заняття 5 Йонний та металічний зв’язки. Вандерваальсові взаємодії, водневий зв’язок. Типи кристалічних ґраток
- •Підготовка до заняття
- •Запитання до практичного заняття
- •Завдання
- •Практичне заняття 6 Електролітична дисоціація
- •Підготовка до заняття
- •Запитання до практичного заняття
- •Завдання
- •Практичне заняття 7 Рівновага в розчинах електролітів
- •Підготовка до заняття
- •Запитання до практичного заняття
- •Завдання
- •Практичне заняття 8 Окисно-відновні реакції
- •Підготовка до заняття
- •Запитання до практичного заняття
- •Завдання
- •2.9 Практичне заняття 9 Зрівнювання рівнянь окисно-відновних реакцій
- •Підготовка до заняття
- •Запитання до практичного заняття
- •Завдання
- •2.10 Практичне заняття 10 Електроліз
- •Підготовка до заняття
- •Запитання до практичного заняття
- •Завдання
- •Розділ 3 підготовка до лабораторних занять
- •Лабораторна робота 1 Визначення ентальпії нейтралізації Теоретична частина
- •Контрольні запитання і вправи
- •Практична частина
- •Література для оформлення роботи і підготовки теоретичного матеріалу
- •Лабораторна робота 2 Швидкість хімічних реакцій Теоретична частина
- •Контрольні запитання і вправи
- •Практична частина
- •Література для оформлення роботи і підготовки теоретичного матеріалу
- •Лабораторна робота 3 Хімічна рівновага Теоретична частина
- •Контрольні запитання і вправи
- •Практична частина
- •Література для оформлення роботи і підготовки теоретичного матеріалу
- •Лабораторна робота 4 Розчинність речовин. Властивості розчинів Теоретична частина
- •Контрольні запитання і вправи
- •Практична частина
- •Література для оформлення роботи і підготовки теоретичного матеріалу
- •Лабораторна робота 5 Приготування розчинів Теоретична частина
- •Контрольні запитання і вправи
- •Практична частина
- •Література для оформлення роботи і підготовки теоретичного матеріалу
- •Лабораторна робота 6 Електролітична дисоціація Теоретична частина
- •Контрольні запитання і вправи
- •Практична частина
- •Література для оформлення роботи і підготовки теоретичного матеріалу
- •Лабораторна робота 7 Гідроліз солей Теоретична частина
- •Контрольні запитання і вправи
- •Практична частина
- •Література для оформлення роботи і підготовки теоретичного матеріалу
- •Лабораторна робота 8 Комплексні сполуки Теоретична частина
- •Контрольні запитання і вправи
- •Практична частина
- •Література для оформлення роботи і підготовки теоретичного матеріалу
- •Лабораторна робота 9 Окисно-відновні реакції Теоретична частина
- •Контрольні запитання і вправи
- •Практична частина
- •Література для оформлення роботи і підготовки теоретичного матеріалу
- •Лабораторна робота 10 Гальванічні елементи Теоретична частина
- •Контрольні запитання і вправи
- •Практична частина
- •Література для оформлення роботи і підготовки теоретичного матеріалу
- •Лабораторна робота 11 Корозія металів Теоретична частина
- •Контрольні запитання і вправи
- •Практична частина
- •Список літератури для оформлення роботи і підготовки теоретичного матеріалу
- •Лабораторна робота 12 Дослідження властивостей елементів ііа-групи та їх сполук Теоретична частина
- •Контрольні запитання і вправи
- •Практична частина
- •Список літератури для оформлення роботи і підготовки теоретичного матеріалу
- •Лабораторна робота 13 Дослідження властивостей алюмінію та сполук Алюмінію Теоретична частина
- •Контрольні запитання і вправи
- •Практична частина
- •Список літератури для оформлення роботи і підготовки теоретичного матеріалу
- •Лабораторна робота 14 Дослідження властивостей заліза та сполук Феруму Теоретична частина
- •Контрольні запитання і вправи
- •Практична частина
- •Список літератури для оформлення роботи і підготовки теоретичного матеріалу
- •Лабораторна робота 15 Дослідження властивостей міді та сполук Купруму Теоретична частина
- •Контрольні запитання і вправи
- •Список літератури для оформлення роботи і підготовки теоретичного матеріалу
- •Лабораторна робота 16 Дослідження властивостей вуглецю та сполук Карбону Теоретична частина
- •Контрольні запитання і вправи
- •Список літератури для оформлення роботи і підготовки теоретичного матеріалу
- •Лабораторна робота 17 Добування і дослідження властивостей аліфатичних вуглеводнів Теоретична частина
- •Контрольні запитання і вправи
- •Практична частина
- •Список літератури для оформлення роботи і підготовки теоретичного матеріалу
- •Лабораторна робота 18 Галогенопохідні алканів Теоретична частина
- •Контрольні запитання і вправи
- •Практична частина
- •Список літератури для оформлення роботи і підготовки теоретичного матеріалу
- •Лабораторна робота 19 Визначення молекулярної маси полімеру віскозиметричним методом Теоретична частина
- •Контрольні запитання і вправи
- •Практична частина
- •Обробка експериментальних даних
- •Список літератури для оформлення роботи і підготовки теоретичного матеріалу
- •Лабораторна робота 20 Дослідження властивостей термопластичних пластмас Теоретична частина
- •Контрольні запитання і вправи
- •Список літератури для оформлення роботи і підготовки теоретичного матеріалу
- •Розділ 4 завдання для індивідуальної домашньої роботи
- •Завдання 1
- •Завдання 2
- •Завдання 3
- •Завдання 4
- •Завдання 5
- •Завдання 6
- •Завдання 7
- •Завдання 8
- •Завдання 9
- •Завдання 10
- •Завдання 11
- •Завдання 12
- •Завдання 13
- •Завдання 14
- •Завдання 15
- •Завдання 16
- •Завдання 24
- •Завдання 25
- •Завдання 26
- •Завдання 27
- •25 Охарактеризуйте полімери за будовою (форма і структура макромолекул, кристалічний та аморфний стан). Відповіді на завдання для самоперевірки
- •1.1 Основні поняття та стехіометричні закони хімії
- •1.2 Основи теорії будови речовини
- •1.3 Комплексні сполуки
- •1.4 Основні закономірності перебігу хімічних реакцій
- •1.5 Властивості розчинів і йонообмінні реакції в розчинах електролітів
- •1.6 Окисно-відновні реакції та електрохімічні процеси
- •1.7 Огляд елементів - металів
- •1.8 Характеристика елементів – неметалів ivа-групи
- •1.9 Основи знань про органічні сполуки і полімерні матеріали
- •Список літератури Використана література
- •Рекомендована література
- •Додатки Додаток а (обов’язковий)
- •Додаток б (обов’язковий)
- •Додаток в (обов’язковий)
- •Додаток г (обов’язковий)
- •Додаток д (обов’язковий )
- •Додаток е (обов’язковий)
Контрольні запитання і вправи
1 Які сполуки називають галогенопохідними вуглеводнів?
2 Охарактеризуйте хлороформ та брометан за такими критеріями: а) будова молекули; б) фізичні властивості (температура кипіння, колір, запах, густина, розчинність у полярних та неполярних розчинниках); в) фізіологічна дія на організм людини; г) правила зберігання та поводження з ними; д) хімічні властивості; е) практичне використання.
3 Які реакції використовують для виявлення Хлору, Брому, Йоду в органічних сполуках? У чому полягає суть цих реакцій?
4 Порівняти зв’язки та за довжиною, енергією, полярністю, реакційною здатністю.
5 Скласти рівняння хімічних реакцій за наведеною схемою:
C2H5NH2
↑
C2H5OH→ C2H5CI→C4H10
↓ ↑
C2H4 →C2H4CI2,
зазначити умови перебігу хімічних реакцій, їх тип і назви речовин.
Практична частина
Мета роботи – дослідити властивості галогенопохідних алканів і ознайомитися з лабораторними способами їх добування.
Обладнання і реактиви: лабораторний штатив, штатив для пробірок, пробірки, гумові пробки, колба Вюрца (100мл), ділильна лійка, нагрівний прилад, сірники, конічна пробірка, градуйовані конічні пробірки, хімічний стакан (50 мл), пінцет, скальпель, фільтрувальний папір, тигельні щипці, мікрошпатель, технохімічні терези, льод, універсальний індикаторний папір, металічний натрій, натрій хлорид (крист.), калій бромід (крист.), етиловий спирт, толуен, бромна вода, соняшникова олія, розчини: сульфатної кислоти (ρ=1,84 г/см3), нітратної кислоти (2 М), аргентум нітрату (0,1 М).
Увага! Всі досліди необхідно виконувати у витяжній шафі!
ДОСЛІД 3.18.1 Властивості хлороформу
А У три пробірки налити по 1 мл: у першу – дистильованої води, у другу – етилового спирту, у третю – толуену. В кожну пробірку додати декілька крапель хлороформу, закрити їх пробками, ретельно збовтати і поставити в штатив на півхвилини. Через зазначений час подивитися на вміст пробірок. Що спостерігається? Зробити висновок про розчинність хлороформу у полярних і неполярних розчинниках.
Б У три пробірки налити по 1 мл хлороформу і одразу закрити їх пробками. У першу пробірку до хлороформу додати 1 мл бромної води, у другу – декілька крапель соняшникової олії, у третю – декілька кристаликів натрій хлориду. Закрити пробірки пробками, ретельно збовтати їх і поставити у штатив на півхвилини. Через зазначений час розглянути вміст пробірок. Зробити висновок про розчинність у хлороформі речовин полярної і неполярної будови.
В Налити в пробірку 0,5 мл хлороформу. Кінець мідного дроту зігнути петелькою або у вигляді спіралі діаметром 1-2 мм. Прожарювати дротину у полум’ї до того часу, поки полум’я не перестане забарвлюватись, охолодити її. Внести дротину в хлороформ , який міститься у пробірці, і знову – в полум’я. Що спостерігається? Зелене забарвлення полум’я свідчить про наявність атома Галогену у складі хлороформу. З якою метою можна використовувати проведену реакцію?
Г Налити в пробірку 0,5 мл хлороформу і 3-4 мл етилового спирту, додати шматочок очищеного натрію завбільшки з невеличку горошину. Що спостерігається? Після повного розчинення натрію і припинення виділення водню розбавити суміш однаковим об’ємом дистильованої води і підкислити розчином нітратної кислоти до кислої реакції (перевірити за допомогою універсального індикаторного паперу). Додати у суміш декілька крапель розчину аргентум нітрату. Що спостерігається? З якою метою можна використовувати проведену реакцію? Пояснити результати досліду, скласти рівняння відповідних реакцій.
ДОСЛІД 3.18.2 Добування і властивості брометану
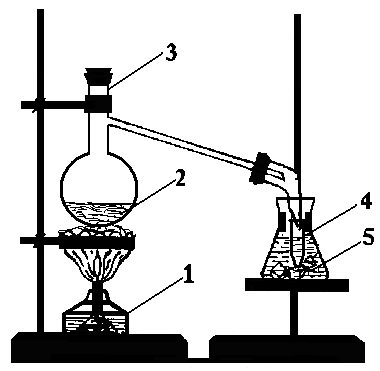
Приготувати суміш, яка складається з 10 мл концентрованої сульфатної кислоти та 10 мл етилового спирту. Що спостерігається при змішуванні цих речовин? Чому? Який запах має утворена суміш? Про що це свідчить? Охолодити суміш. Закріпити колбу Вюрца в лапці штатива і налити в неї приготовану суміш. Налити також в реакційну колбу 5 мл дистильованої води і насипати 5-7 г калій броміду (наважку зважити на технохімічних терезах). Закрити колбу пробкою. У конічну пробірку-приймач налити 2мл дистильованої води, помістити її в хімічний стакан з льодом. Отвір газовідвідної трубки, сполученої з реакційною колбою, занурити у пробірку-приймач (рис. 3.2 ).
Почати обережно нагрівати реакційну колбу на невеличкому полум’ї. Через декілька хвилин спостерігати появу маслянистих крапель брометану у пробірці-приймачі під шаром води. Коли у пробірку-приймач перестануть потрапляти краплі брометану, вийняти газовідвідну трубку з приймача, а потім припинити нагрівання реакційної колби.
За допомогою ділильної лійки відділити брометан.
Дослідити розчинність брометану в різних розчинниках та його розчинювальну здатність (див. дослід 3.18.1).
|
Зробити висновки про розчинність брометану у неполярних та полярних розчинниках, а також його розчинювальну здатність. Довести наявність Брому у складі брометану двома способами (див. дослід 3.18.1). Пояснити результати досліду, скласти рівняння відповідних реакцій. |
Рисунок 3.2 - Синтез брометану: 1 - нагрівний прилад; 2 - реакційна суміш; 3 - колба Вюрца; 4 - пробірка-приймач; 5 - охолоджувальна суміш |