- •Ю. В. Ліцман, л. І. Марченко, с. Ю. Лебедєв Самостійна робота студентів при вивченні Хімії
- •Самостійна робота студентів при вивченні Хімії
- •Самостійна робота студентів при вивченні Хімії
- •Розділ 1 підготовка до опрацювання теоретичного матеріалу
- •Основні поняття та стехіометричні закони хімії
- •Результати вивчення розділу
- •Література для підготовки теоретичного матеріалу
- •План вивчення розділу
- •Приклади розв’язання типових задач і виконання завдань до розділу Основні поняття та стехіометричні закони хімії
- •Завдання для самоперевірки
- •Основи теорії будови речовини
- •Результати вивчення розділу
- •Література для підготовки теоретичного матеріалу
- •План вивчення теми
- •Приклади виконання типових завдань
- •Завдання для самоперевірки
- •Комплексні сполуки
- •Результати вивчення розділу
- •Література для підготовки теоретичного матеріалу
- •План вивчення розділу
- •Приклади виконання типових завдань
- •Завдання для самоперевірки
- •Основні закономірності перебігу хімічних реакцій
- •Результати вивчення теми
- •Література для підготовки теоретичного матеріалу
- •Приклади розв’язання типових задач і виконання завдань
- •Властивості розчинів і йонообмінні реакції в розчинах електролітів
- •Результати вивчення розділу
- •Література для підготовки теоретичного матеріалу
- •План вивчення розділу
- •Приклади розв’язання типових задач і виконання завдань
- •Завдання для самоперевірки
- •Окисно-відновні реакції та електрохімічні процеси
- •Результати вивчення розділу
- •Література для підготовки теоретичного матеріалу
- •План вивчення розділу
- •Приклади розв’язання типових задач і виконання завдань
- •Завдання для самоперевірки
- •1.7 Огляд елементів - металів
- •Результати вивчення розділу
- •Література для підготовки теоретичного матеріалу
- •План вивчення розділу
- •Приклади розв’язання типових задач і виконання завдань
- •1.8 Характеристика елементів - неметалів ivа-групи
- •Результати вивчення розділу
- •Література для підготовки теоретичного матеріалу
- •План вивчення розділу
- •Приклади розв’язання типових задач і виконання завдань
- •1.9 Основи знань про органічні сполуки і полімерні матеріали
- •Результати вивчення розділу
- •Розділ 2 підготовка до практичних занять
- •2.1 Практичне заняття 1 Основні закони хімії
- •Підготовка до заняття
- •Запитання до практичного заняття
- •2.2 Практичне заняття 2 Будова електронних оболонок атома
- •Підготовка до заняття
- •Запитання до практичного заняття
- •Завдання
- •2.3 Практичне заняття 3 Періодичний закон і електронна природа атомів
- •Підготовка до заняття
- •Запитання до практичного заняття
- •Завдання
- •2.4 Практичне заняття 4 Ковалентний зв’язок. Метод валентних зв’язків (мвз)
- •Підготовка до заняття
- •Запитання до практичного заняття
- •Завдання
- •2.5 Практичне заняття 5 Йонний та металічний зв’язки. Вандерваальсові взаємодії, водневий зв’язок. Типи кристалічних ґраток
- •Підготовка до заняття
- •Запитання до практичного заняття
- •Завдання
- •Практичне заняття 6 Електролітична дисоціація
- •Підготовка до заняття
- •Запитання до практичного заняття
- •Завдання
- •Практичне заняття 7 Рівновага в розчинах електролітів
- •Підготовка до заняття
- •Запитання до практичного заняття
- •Завдання
- •Практичне заняття 8 Окисно-відновні реакції
- •Підготовка до заняття
- •Запитання до практичного заняття
- •Завдання
- •2.9 Практичне заняття 9 Зрівнювання рівнянь окисно-відновних реакцій
- •Підготовка до заняття
- •Запитання до практичного заняття
- •Завдання
- •2.10 Практичне заняття 10 Електроліз
- •Підготовка до заняття
- •Запитання до практичного заняття
- •Завдання
- •Розділ 3 підготовка до лабораторних занять
- •Лабораторна робота 1 Визначення ентальпії нейтралізації Теоретична частина
- •Контрольні запитання і вправи
- •Практична частина
- •Література для оформлення роботи і підготовки теоретичного матеріалу
- •Лабораторна робота 2 Швидкість хімічних реакцій Теоретична частина
- •Контрольні запитання і вправи
- •Практична частина
- •Література для оформлення роботи і підготовки теоретичного матеріалу
- •Лабораторна робота 3 Хімічна рівновага Теоретична частина
- •Контрольні запитання і вправи
- •Практична частина
- •Література для оформлення роботи і підготовки теоретичного матеріалу
- •Лабораторна робота 4 Розчинність речовин. Властивості розчинів Теоретична частина
- •Контрольні запитання і вправи
- •Практична частина
- •Література для оформлення роботи і підготовки теоретичного матеріалу
- •Лабораторна робота 5 Приготування розчинів Теоретична частина
- •Контрольні запитання і вправи
- •Практична частина
- •Література для оформлення роботи і підготовки теоретичного матеріалу
- •Лабораторна робота 6 Електролітична дисоціація Теоретична частина
- •Контрольні запитання і вправи
- •Практична частина
- •Література для оформлення роботи і підготовки теоретичного матеріалу
- •Лабораторна робота 7 Гідроліз солей Теоретична частина
- •Контрольні запитання і вправи
- •Практична частина
- •Література для оформлення роботи і підготовки теоретичного матеріалу
- •Лабораторна робота 8 Комплексні сполуки Теоретична частина
- •Контрольні запитання і вправи
- •Практична частина
- •Література для оформлення роботи і підготовки теоретичного матеріалу
- •Лабораторна робота 9 Окисно-відновні реакції Теоретична частина
- •Контрольні запитання і вправи
- •Практична частина
- •Література для оформлення роботи і підготовки теоретичного матеріалу
- •Лабораторна робота 10 Гальванічні елементи Теоретична частина
- •Контрольні запитання і вправи
- •Практична частина
- •Література для оформлення роботи і підготовки теоретичного матеріалу
- •Лабораторна робота 11 Корозія металів Теоретична частина
- •Контрольні запитання і вправи
- •Практична частина
- •Список літератури для оформлення роботи і підготовки теоретичного матеріалу
- •Лабораторна робота 12 Дослідження властивостей елементів ііа-групи та їх сполук Теоретична частина
- •Контрольні запитання і вправи
- •Практична частина
- •Список літератури для оформлення роботи і підготовки теоретичного матеріалу
- •Лабораторна робота 13 Дослідження властивостей алюмінію та сполук Алюмінію Теоретична частина
- •Контрольні запитання і вправи
- •Практична частина
- •Список літератури для оформлення роботи і підготовки теоретичного матеріалу
- •Лабораторна робота 14 Дослідження властивостей заліза та сполук Феруму Теоретична частина
- •Контрольні запитання і вправи
- •Практична частина
- •Список літератури для оформлення роботи і підготовки теоретичного матеріалу
- •Лабораторна робота 15 Дослідження властивостей міді та сполук Купруму Теоретична частина
- •Контрольні запитання і вправи
- •Список літератури для оформлення роботи і підготовки теоретичного матеріалу
- •Лабораторна робота 16 Дослідження властивостей вуглецю та сполук Карбону Теоретична частина
- •Контрольні запитання і вправи
- •Список літератури для оформлення роботи і підготовки теоретичного матеріалу
- •Лабораторна робота 17 Добування і дослідження властивостей аліфатичних вуглеводнів Теоретична частина
- •Контрольні запитання і вправи
- •Практична частина
- •Список літератури для оформлення роботи і підготовки теоретичного матеріалу
- •Лабораторна робота 18 Галогенопохідні алканів Теоретична частина
- •Контрольні запитання і вправи
- •Практична частина
- •Список літератури для оформлення роботи і підготовки теоретичного матеріалу
- •Лабораторна робота 19 Визначення молекулярної маси полімеру віскозиметричним методом Теоретична частина
- •Контрольні запитання і вправи
- •Практична частина
- •Обробка експериментальних даних
- •Список літератури для оформлення роботи і підготовки теоретичного матеріалу
- •Лабораторна робота 20 Дослідження властивостей термопластичних пластмас Теоретична частина
- •Контрольні запитання і вправи
- •Список літератури для оформлення роботи і підготовки теоретичного матеріалу
- •Розділ 4 завдання для індивідуальної домашньої роботи
- •Завдання 1
- •Завдання 2
- •Завдання 3
- •Завдання 4
- •Завдання 5
- •Завдання 6
- •Завдання 7
- •Завдання 8
- •Завдання 9
- •Завдання 10
- •Завдання 11
- •Завдання 12
- •Завдання 13
- •Завдання 14
- •Завдання 15
- •Завдання 16
- •Завдання 24
- •Завдання 25
- •Завдання 26
- •Завдання 27
- •25 Охарактеризуйте полімери за будовою (форма і структура макромолекул, кристалічний та аморфний стан). Відповіді на завдання для самоперевірки
- •1.1 Основні поняття та стехіометричні закони хімії
- •1.2 Основи теорії будови речовини
- •1.3 Комплексні сполуки
- •1.4 Основні закономірності перебігу хімічних реакцій
- •1.5 Властивості розчинів і йонообмінні реакції в розчинах електролітів
- •1.6 Окисно-відновні реакції та електрохімічні процеси
- •1.7 Огляд елементів - металів
- •1.8 Характеристика елементів – неметалів ivа-групи
- •1.9 Основи знань про органічні сполуки і полімерні матеріали
- •Список літератури Використана література
- •Рекомендована література
- •Додатки Додаток а (обов’язковий)
- •Додаток б (обов’язковий)
- •Додаток в (обов’язковий)
- •Додаток г (обов’язковий)
- •Додаток д (обов’язковий )
- •Додаток е (обов’язковий)
Контрольні запитання і вправи
1 Як класифікують вуглеводні?
2 Які вуглеводні називають: а) алканами; б) алкенами; в) алкінами?
3 Поясніть, чому для алкенів і алкінів типовими є реакції приєднання, а для алканів – заміщення.
4 Які загальні фізичні властивості характерні для вуглеводнів?
5 Складіть рівняння реакцій: а)горіння; б) хлорування; в) нітрування; г) крекінгу; д) ізомеризації для н-гексану. Назвіть продукти реакцій.
6 Складіть рівняння реакцій: а) горіння; б) хлорування; в) гідратації; г) гідробромування; д) окиснення водним розчином калій перманганату для пропену і пропіну. Назвіть продукти реакцій.
7 Які реакції можна застосувати для визначення: а) алканів, б) алкенів, в) алкінів?
8 У трьох пробірках, закритих пробками, містяться метан, етилен, ацетилен. Як визначити, в якій пробірці міститься кожен з газів? Складіть план розпізнавання і відповідні рівняння хімічних реакцій.
Практична частина
Мета роботи – дослідити хімічні властивості аліфатичних вуглеводнів і ознайомитися з лабораторними способами добування етилену та ацетилену.
Обладнання і реактиви: лабораторний штатив, штатив для пробірок, пробірки, гумові пробки, пробки з газовідвідними трубками, нагрівний прилад, сірники, конічна колба (100 мл), хімічний стакан (50 мл), градуйована конічна пробірка, звичайний циліндр, кристалізатор, скляна пластинка, порцелянова пластинка, кип’ятильні камінці, ложечка для спалювання речовин, довга тонка скіпка, товстостінна банка, калій перманганат (крист.), етиловий спирт, гексан, розчини: бромної води, калій перманганату (0,5 Н), хлоридної кислоти (ρ=1,19 г/см3), сульфатної кислоти (ρ=1,84 г/см3).
Увага! Всі досліди необхідно виконувати у витяжній шафі!
ДОСЛІД 3.17.1 Властивості гексану
Налити у дві пробірки по 0,5 мл гексану. У першу пробірку до гексану додати 0,5 мл бромної води, закрити її пробкою і збовтати. Що спостерігається?
У другу пробірку до гексану додати 0,5 мл розчину калій перманганату, закрити її пробкою і збовтати. Що спостерігається?
У ложечку для спалювання речовин налити декілька крапель гексану, підпалити його. Яким полум’ям горить гексан?
Зробити висновки про фізичні та хімічні властивості гексану. Скласти рівняння реакції горіння гексану.
ДОСЛІД 3.17.2 Добування і властивості етилену
Зібрати прилад для добування газів, перевірити його на герметичність (Для цього опустіть кінець газовідвідної трубки у воду, пробірку затисніть у долоні, якщо прилад герметичний, то повітря, яке розширилося від нагрівання, виходитиме через воду, а при охолодженні приладу вода буде втягуватися в трубку).
В одну пробірку налити 2 мл бромної води, а в іншу – 2 мл розчину калій перманганату.
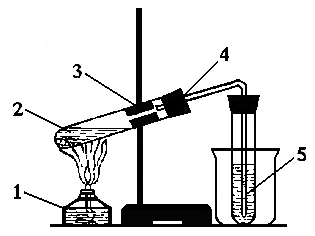
Приготувати суміш етилового спирту (1 мл) та концентрованої сульфатної кислоти (3 мл), охолодити її, перелити у пробірку. Помістити у реакційну суміш кип’ятильні камінці, закрити пробірку пробкою з газовідвідною трубкою. Закріпити пробірку у лапці штатива похило під кутом 45-600. Почати обережно нагрівати пробірку з реакційною сумішшю. Коли розпочнеться реакція, газ, що виділяється, пропустити у пробірку з бромною водою, зануривши газовідвідну трубку до дна пробірки (рис. 3.1) (для зручності пробірку з бромною водою можна поставити у стакан).
Потім пропустити етилен у пробірку з розчином калій перманганату.
Звичайний циліндр наповнити водою і накрити його отвір скляною пластинкою Перевернути циліндр догори дном, підтримуючи скляну пластинку, і внести його у кристалізатор з водою. Під водою зняти скляну пластинку.
Зібрати етилен у циліндр методом витіснення води (спрямувати газовідвідну трубку в циліндр). Чому етилен можна збирати методом витіснення води? Після повного заповнення циліндра етиленом закрити його отвір скляною пластинкою і вийняти з кристалізатора. Зняти скляну
|
пластинку з отвору циліндра і підпалити етилен. Повільно наливати в циліндр воду до припинення горіння етилену. Яким полум’ям горить етилен? Вийняти газовідвідну трубку з води і, повернувши її отвором угору, підпалити етилен. Внести у полум’я |
Рисунок 3.1 - Добування етилену: 1 - спиртівка; 2 - реакційна суміш; 3 - лапка лабораторного штатива; 4 - пробка з газовідвідною трубкою; 5 - пробірка з бромною водою |
порцелянову пластинку. Зробити висновки про хімічні властивості етилену та лабораторні способи його добування. Скласти рівняння реакцій дегідратації етанолу, горіння етилену, взаємодії етилену з бромною водою та окиснення етилену калій перманганатом.
ДОСЛІД 3.17.3 Добування і властивості ацетилену
А Зібрати прилад для добування газів і перевірити його на герметичність. В одну пробірку налити 2 мл бромної води, а в іншу – 2 мл розчину калій перманганату. У пробірку приладу для добування газів налити 4 мл води і помістити 2-3 кусочки кальцій карбіду розміром з невеличку горошину, закрити пробірку пробкою з газовідвідною трубкою і закріпити пробірку у лапці штатива. Коли розпочнеться реакція, газ, що виділяється, пропускати протягом 2 хвилин у пробірку з бромною водою, зануривши газовідвідну трубку до дна пробірки. Що спостерігається? Пояснити, чому ацетилен взаємодіє з бромною водою повільніше, ніж етилен.
Потім пропускати ацетилен у пробірку з розчином калій перманганату. Що спостерігається?
Б У конічну колбу помістити 2-3 мікрошпателі кристалічного калій перманганату, додати декілька крапель концентрованої хлоридної кислоти. Закрити колбу пробкою. Що спостерігається? Через 1,5-2 хвилини відкрити конічну колбу і спрямувати у неї отвір газовідвідної трубки, через яку виділяється ацетилен. Що спостерігається?
В Вийняти газовідвідну трубку з конічної колби і, повернувши її отвором вгору, підпалити ацетилен. Яким полум’ям горить ацетилен?
Зробити висновки про хімічні властивості ацетилену та лабораторні способи його добування. Скласти рівняння хімічних реакцій добування ацетилену, горіння ацетилену, взаємодії ацетилену з бромною водою, взаємодії ацетилену з хлором, окиснення ацетилену калій перманганатом.