
- •Контрольные вопросы
- •Тема 1. Расчет тепловых эффектов физических и химических превращений
- •Тема 2. Расчет тепловых эффектов физических и химических превращений при различных температурах
- •Тема 3. Расчет характеристических термодинамических функций
- •Тема 4. Химическое равновесие. Влияние внешних условий на равновесное состояние
- •Тема 5. Фазовые равновесия в двухкомпонентных системах
Сусл = 1 – 2 + 1 = 0,
система безвариантна – в этой точке нельзя менять ни один параметр (температура, состав), не нарушив равновесия.
В точке I число независимых компонентов К = 2; (число фаз Ф = 2 (жидкость и пар),
Сусл = 2 – 2 + 1 = 1,
у системы есть одна степень свободы.
В точке О число независимых компонентов К = 2, число фаз Ф = 2 (жидкость и пар). Следует учесть, что в данном случае в уравнение (68) вводится дополнительное ограничение, связанное с тем, что состав жидкости и состав пара одинаков.
Сусл = 2 – 1 - 2 + 1 = 0,
в этой точке нельзя менять ни один параметр (температура, состав), не нарушив равновесия.
Задача №22
Два вещества (А и В) не образуют твердых растворов, но в расплавленном состоянии смешиваются друг с другом в любых соотношениях. Постройте диаграмму фазового состояния (диаграмму плавкости) двухкомпонентной системы (А - В), зная температуру начала кристаллизации системы (табл. 21, состав задан по веществу А, мольн.%).
Обозначьте точками: I – жидкий плав, содержащий а% вещества А при температуре T1; II – плав, содержащий а% вещества А, находящийся в равновесии с кристаллами химического соединения; III – систему, состоящую из твердого вещества А в равновесии с расплавом, содержащим б% вещества А; IV – равновесие трех фаз (табл. 22).
Определите составы химических соединений.
Определите качественные и количественные составы эвтектик.
Определите число фаз и число термодинамических степеней свободы системы при эвтектической температуре и содержании компонента А 95%.
5. При какой температуре начнет отвердевать расплав, содержащий в% вещества А? При какой температуре он отвердеет полностью? Каков состав первых выпавших кристаллов?
Вычислите теплоты плавления веществ А и В.
Таблица 21
Вариант |
Система |
Состав А, мольн.% |
T, К начала кристаллизации |
1 |
2 |
3 |
4 |
1 |
A – KCl B – SnCl2 |
0 5 10 15 20 25 30 35 40 45 50 52,5 55 70 80 100 |
512 507 496 479 477 481 478 473 460 481 497 583 658 853 952 1050 |
2 |
A – KJ B – CdJ2 |
0 10 30 45 47 49 53 55 60 65 80 100 |
658 643 696 520 470 468 504 515 575 656 833 951 |
Продолжение таблицы 21
1 |
2 |
3 |
4 |
3 |
A – KCl B – MnCl2 |
0 8 15 25 34 36 38 40 50 60 65 66 75 85 100
|
923 825 865 715 745 722 735 747 769 731 705 701 705 925 1047
|
4 |
A – SrBr2 B – LiBr |
0 5 20 30 34 40 50 60 66,6 85 100
|
825 813 772 736 720 744 768 773 803 865 916
|
Продолжение таблицы 21
1 |
2 |
3 |
4 |
5 |
A – MgSO4 B – Cs2SO4 |
0 10 20 30 40 45 47 50 55 60 63 65 70 80 90 100 |
1292 1241 1193 1116 1013 953 969 999 1048 1083 1098 1113 1163 1238 1323 1397 |
6 |
A – RbCl B – SrCl2 |
0 10 20 30 40 45 50 55 65 70 75 80 90 100 |
1147 1089 1004 906 964 975 978 968 896 827 853 879 960 999 |
Продолжение таблицы 21
1 |
2 |
3 |
4 |
7 |
A – KCl B – PbCl2 |
0 10 20 25 30 33,5 40 45 50 55 65 75 90 100 |
769 748 713 701 710 713 707 693 703 733 811 893 1003 1048 |
8 |
A – CsCl B – SrCl2 |
0 10 15 20 25 35 40 50 60 70 80 85 95 100
|
1147 1124 1089 1059 1102 1155 1166 1180 1158 1071 877 862 875,8 876,8
|
Продолжение таблицы 21
1 |
2 |
3 |
4 |
9 |
A – KCl B – CaCl2 |
0 10 20 25 31 35 45 50 55 65 75,5 77,5 80 85 89,5 90 95 100 |
1293 1216 1113 1069 953 963 1003 1011 1007 983 903 906 910 905 983 910 1055 1129 |
10 |
A – FeCl3 B – TlCl |
0 10 22 26 29 33 35 37 45 52 62 100 |
702 658 598 535 549 563 525 506 533 553 572 575 |
Продолжение таблицы 21
1 |
2 |
3 |
4 |
11 |
A – CuCl2 B – CsCl |
0 10 20 35 45 50 60 65 66,6 70 75 80 90 100 |
912 868 814 645 571 549 533 542 547 541 521 541 623 695 |
12 |
A – CdCl2 B – TlCl |
0 10 20 28 30 36,5 47 50 57,5 67,5 80 85 95 100 |
702 656 604 572 589 645 694 699 697 673 754 777 823 841 |
Продолжение таблицы 21
1 |
2 |
3 |
4 |
13 |
A – SrBr2 B – LiBr |
0 5 20 30 34 40 50 60 66,6 85 100 |
825 813 772 736 720 744 768 773 803 865 916 |
14 |
A – InCl3 B – NaCl |
0 13,3 22,2 35,8 37,6 40 47 50,6 53 61,6 66,8 74,6 80,6 81,6 84,8 100 |
1073 1052 1033 989 975 983 999 1013 983 753 680 641 622 642 697 859 |
15 |
A – MgCl2 B – TlCl |
0 5 15 28 33,3 50 66,6 75 90 100 |
708 698 682 635 685 767 796 658 950 951 |
Продолжение таблицы 21
1 |
2 |
3 |
4 |
16
|
A – SrBr2 B – KBr |
0 10 25 29 33,3 40 50 57 66,7 75 82 85 95 100 |
1003 972 872 829 832 826 807 832 847 843 835 851 897 916 |
17 |
A – NiF2 B – KF |
0 4,9 9,2 13,4 15,2 18,4 21,8 23,8 26 30,3 37,9 46,7 50,5 58 |
1121 1099 1060 1120 1141 1168 1193 1212 1224 1289 1359 1397 1403 1391 |
Продолжение таблицы 21
1 |
2 |
3 |
4 |
18 |
A – KJ B – KF |
0 10 20 25 30 31 35 40 45 50 55 60 70 80 90 100 |
685 668 640 622 579 594 603 610 618 622 651 695 773 858 914 959 |
19 |
A – PbCl2 B – TlCl |
0 10 15,5 20 25 30 36,5 40 50 60 66,6 70 75 80 90 100 |
708 679 661 675 680 676 650 658 680 705 708 707 700 720 752 773 |
Продолжение таблицы 21
1 |
2 |
3 |
4 |
20 |
A – MgSO4 B – K2SO4 |
0 10 20 30 40 50 63,9 66,8 71 75,3 82,2 100 |
1349 1308 1236 1123 1019 1103 1200 1203 1193 1177 1247 1397 |
21 |
A – MnCl2 B – RbCl |
0 15 22 27 30 32 35 40 45 50 55 65 68 70 80 100 |
999 879 813 749 741 733 713 767 793 799 797 755 733 743 803 923 |
Продолжение таблицы 21
1 |
2 |
3 |
4 |
22 |
A – LiNO3 B – Pb(NO3)2
|
0 10 20 22 32,5 36 40 50 60 65 70 80 90 100 |
585 535,5 489 479 424 438 449,5 464 457,6 449 567 598 519,5 527 |
23 |
A – MnCl2 B – RbCl |
0 17,5 22,7 23,7 25,9 28 29 30,4 33,1 35,5 36,2 37,5 43,8 50 58,1 65 68,3 78,7 100 |
991 868 800 764 746 736 732 743 749 745 759 784 816 823 809 783 821 989 984 |
Продолжение таблицы 21
1 |
2 |
3 |
4 |
24 |
A – Li2SO4 B – Cs2SO4 |
0 5 10 18,5 20 25 35 40 45 55 67 70 90 100 |
1043 1023 978 911 828 980 1022 1027 1015 961 873 899 1021 1049 |
25 |
A – HgBr2 B – HgJ2 |
0 10 20 30 40 50 55 60 65 70 80 90 100
|
528,4 518 509,2 500,8 494,1 490,3 489,3 489,1 489,6 490,8 495,2 501,9 509,5
|
Продолжение таблицы 21
1 |
2 |
3 |
4 |
26 |
A – Mg B – Cu
|
0 8 15 20 35 43 50 55 60 65 75 100
|
1085 680 800 750 550 590 550 500 450 380 500 645
|
27 |
A – Si B –Cr |
0 10 20 25 30 40 50 60 70 80 90 100
|
2173 1823 1973 1993 1973 1873 1823 1703 1793 1673 1643 1693
|
Продолжение таблицы 21
1 |
2 |
3 |
4 |
28 |
A – Mg B –Ca |
0 10 20 30 42 50 60 70 80 90 100
|
1081 973 718 923 994 981 931 873 791 873 913
|
29 |
A – KBr B – AgBr |
0 10 20 30 40 50 60 70 80 90 100 |
683 643 553 543 628 723 823 863 903 973 1023 |
30 |
A – LiCl B – KCl |
0 10 20 30 40 50 60 70 80 90 100 |
1046 1023 973 923 848 723 634 698 773 823 874 |
Таблица 22
Вариант |
Т1, К |
а, мол. % |
б, мол. % |
в, мол. % |
1 |
483 |
45 |
75 |
5 |
2 |
723 |
55 |
75 |
10 |
3 |
873 |
40 |
80 |
10 |
4 |
873 |
50 |
80 |
10 |
5 |
1210 |
40 |
75 |
10 |
6 |
1173 |
55 |
90 |
10 |
7 |
1073 |
35 |
85 |
5 |
8 |
1100 |
30 |
75 |
5 |
9 |
1173 |
35 |
90 |
10 |
10 |
660 |
40 |
95 |
10 |
11 |
673 |
30 |
50 |
5 |
12 |
773 |
55 |
80 |
10 |
13 |
973 |
43 |
80 |
10 |
14 |
1033 |
60 |
90 |
10 |
15 |
923 |
45 |
95 |
100 |
16 |
933 |
50 |
80 |
10 |
17 |
1273 |
60 |
90 |
10 |
18 |
873 |
15 |
– |
5 |
19 |
773 |
40 |
75 |
10 |
20 |
1273 |
85 |
10 |
10 |
21 |
873 |
50 |
90 |
10 |
22 |
523 |
30 |
95 |
10 |
23 |
883 |
40 |
75 |
10 |
24 |
1023 |
40 |
90 |
10 |
25 |
600 |
25 |
75 |
5 |
26 |
900 |
50 |
90 |
5 |
27 |
1200 |
60 |
90 |
10 |
28 |
1000 |
20 |
10 |
90 |
29 |
850 |
40 |
– |
10 |
30 |
980 |
40 |
– |
10 |
Решение:
Проанализируем диаграмму «температура–состав» для бинарной системы Li2CO3 – K2CO3 (табл. 23).
Построим диаграмму плавкости (рис. 5) – зависимость температуры кристаллизации от состава системы. Соединим точки на диаграмме линией (линия С G E1 XC E2 D). Это – линия ликвидуса. Точка максимума на ней (точка ХС) отвечает образованию устойчивого химического соединения. Точки минимума E1 и E2 – эвтектические точки. Эвтектикой называется смесь двух веществ, кристаллизующаяся при единой температуре.
Сделаем дополнительные построения: опустим перпендикуляр из точки ХС, проведем две горизонтальные линии через точки E1 и E2. Горизонтальные линии МE1 и E2N – линии солидуса.
Таблица 23
Система |
Состав А, молярн.% |
T, К начала кристаллизации |
A – Li2CO3 B – K2CO3 |
0 9 20 33 39,5 44,2 50 54,5 62 66,6 83,5 100 |
1133 1060 955 733 765 778 788 778 765 798 911 983 |
Линии делят диаграмму на ряд областей. Выше линии ликвидуса любая смесь находится в жидком (расплавленном) состоянии. Ниже линии солидуса система находится в твердом состоянии и представляет из себя смесь кристаллов двух видов. В левой части диаграммы это смесь кристаллов вещества В (K2CO3) и кристаллов химического соединения. В правой части диаграммы - смесь кристаллов вещества А (Li2CO3) и кристаллов химического соединения. В заштрихованных областях в равновесии находятся жидкая и кристаллическая фазы.
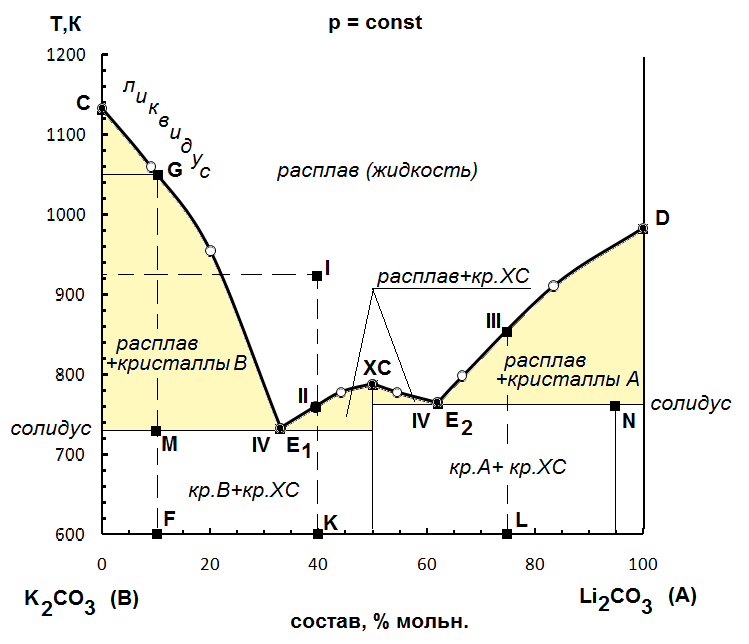
Рисунок 5 – Диаграмма плавкости для системы Li2CO3 – K2CO3
1. Обозначим точками:
I – жидкий плав, содержащий при температуре T1 = 923К 40% Li2CO3. Для этого найдем на оси абсцисс точку, соответствующую составу 40% Li2CO3 – это точка К. На оси ординат отмечаем температуру T1 = 923К. На пересечении линий получаем точку I, которая расположена в области выше линии ликвидуса, т.е. в области жидкого расплава;
II – плав, содержащий 40% Li2CO3, находящийся в равновесии с кристаллами химического соединения. Аналогичным образом найдем на оси абсцисс точку, соответствующую составу 40% Li2CO3 – это точка К. Восстановим перпендикуляр до пересечения с линией ликвидуса и получим точку II;
III – систему, состоящую из твердого Li2CO3 в равновесии с расплавом, содержащим 75% Li2CO3. Для этого найдем на оси абсцисс точку, соответствующую составу 75% Li2CO3 – это точка L. Восстановим перпендикуляр до пересечения с линией ликвидуса и получим точку III. На ветви ликвидуса DE2 в твердую фазу переходит компонент системы Li2CO3; расплав при этом обогащается компонентом K2CO3.
IV – равновесие трех фаз. Равновесие трех фаз имеет место в точках эвтектики E1 и E2.
2. Определим составы химических соединений.
На представленной диаграмме одно химическое соединение (ХС), характеризующееся составом 50% компонента Li2CO3 и 50% компонента K2CO3.
3. Определим качественные и количественные составы эвтектик.
Качественный состав: твердые эвтектики состоят из кристаллов K2CO3 и кристаллов химического соединения (E1) и из кристаллов Li2CO3 и кристаллов химического соединения (E2).
Количественный состав:
Е1 – 33% Li2CO3 и 67% K2CO3.
Е2 – 62% Li2CO3 и 38% K2CO3.
4. Определим по уравнению (68) число фаз и число термодинамических степеней свободы С системы при эвтектической температуре и 95% содержании компонента Li2CO3. При Т = 765 К (точка N) система трехфазна (Ф = 3) – в равновесии находятся две твердых фазы (кристаллы химического соединения и кристаллы K2CO3) и жидкий расплав; число компонентов К = 2, число внешних факторов n = 1, т.к. (p = const).Число степеней свободы
Сусл = 2 – 3 + 1 = 0.
Система безвариантна – в этой точке нельзя менять ни один параметр (температура, состав), не нарушив равновесия.
5. При какой температуре начнет отвердевать расплав, содержащий 10% Li2CO3? При какой температуре он отвердеет полностью? Каков состав первых выпавших кристаллов?
Для ответа на эти вопросы найдем на оси абсцисс точку, соответствующую составу 10% Li2CO3 – это точка F. Восстановим перпендикуляр до пересечения с линией ликвидуса в точке G, т.к. точки, лежащие на линии ликвидуса отвечают температуре начала кристаллизации. Для анализируемого состава получим температуру начала кристаллизации T = 1050 К. По линии GF осуществляется охлаждение расплава, содержащего 10% Li2CO3 до достижения линии солидуса в точке M. Расплав отвердеет полностью при эвтектической температуре T = 730 К. В процессе кристаллизации в твердую фазу переходит тот компонент, которого в системе больше (по сравнению с эвтектической точкой), на основании этого состав первых выпавших кристаллов – 100 % K2CO3.
6. Вычислим теплоты плавления веществ Li2CO3 и K2CO3.
Зависимость температуры кристаллизации расплава от состава расплава выражается уравнением Шредера:
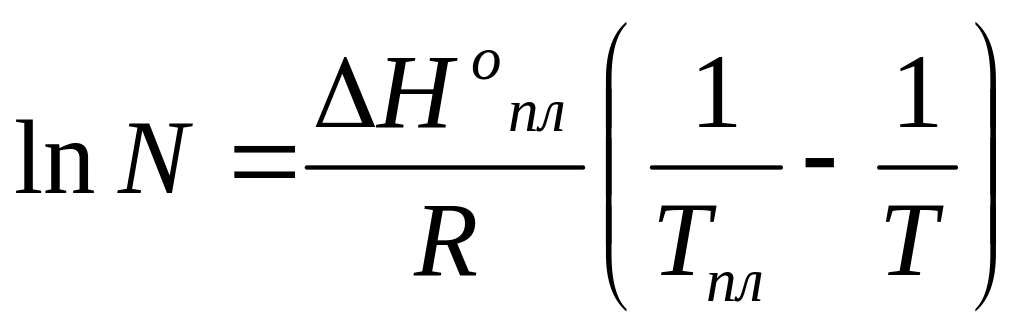 ,
(69)
,
(69)
где N – мольная доля вещества в смеси;
![]() – мольная
теплота плавления чистого вещества;
– мольная
теплота плавления чистого вещества;
![]() – температура
плавления чистого вещества;
– температура
плавления чистого вещества;
T – температура начала кристаллизации расплава с мольной долей N.
Рассчитаем теплоту плавления вещества Li2CO3.
Для
расчета возьмем сплав, содержащий 90%
Li2CO3.
Мольная доля Li2CO3
в системе
![]() =
0,9. Температура начала кристаллизации
системы, содержащей 90% Li2CO3
T
= 935 К. По диаграмме Tпл(Li2CO3)
= 983 К (точка D).
=
0,9. Температура начала кристаллизации
системы, содержащей 90% Li2CO3
T
= 935 К. По диаграмме Tпл(Li2CO3)
= 983 К (точка D).
По уравнению Шредера вычислим теплоту плавления вещества Li2CO3:
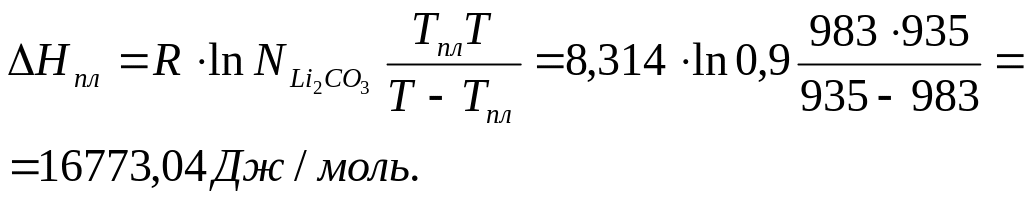
Теплота плавления Li2CO3 составила 16,8 кДж/моль.
Аналогичным
образом рассчитаем теплоту плавления
вещества K2CO3.
Для расчета возьмем сплав, содержащий
90% K2CO3.
Мольная доля K2CO3
в системе
![]() =
0,9. Температура начала кристаллизации
системы, содержащей 90% K2CO3
T
= 1050 К (см. пункт 5). По диаграмме Tпл(K2CO3)
= 1133 К (точка C).
=
0,9. Температура начала кристаллизации
системы, содержащей 90% K2CO3
T
= 1050 К (см. пункт 5). По диаграмме Tпл(K2CO3)
= 1133 К (точка C).
По уравнению Шредера вычислим теплоту плавления вещества K2CO3:
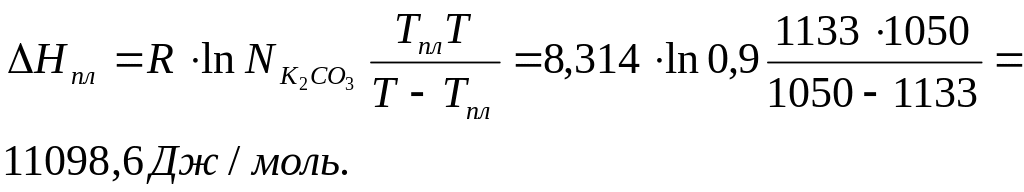
Теплота плавления K2CO3 составила 11,1 кДж/моль.
Контрольные вопросы
Тема 1. Расчет тепловых эффектов физических и химических превращений
1. Сформулируйте и объясните I закон термодинамики.
2. Поясните физический смысл величин, входящих в I закон термодинамики.
3. В чем заключается отличие теплоты и работы?
4. В чем отличие теплоты и работы от внутренней энергии?
5. Сформулируйте закон Гесса и его следствия. Для каких физико-химических процессов он применяется?
6. Дайте определение теплового эффекта химической реакции. Какие виды тепловых эффектов вы знаете?
7. Что такое внутренняя энергия, каковы ее общие свойства?
8. Сформулируйте понятие энтальпии реакции. Охарактеризуйте ее свойства.
9. Как связаны между собой энтальпия и внутренняя энергия?
10. Что такое стандартный тепловой эффект?
11. Дайте определение теплоты образования и теплоты сгорания.
12. Какие методы расчета тепловых эффектов при стандартных условиях вы знаете?
13. Как найти тепловой эффект реакции при стандартных условиях с помощью теплот образования и сгорания?
14. В чем заключается метод расчета тепловых эффектов при стандартных условиях по термохимическим уравнениям и схемам?
15. Как произвести расчет теплового эффекта реакции по энергиям химических связей?
Тема 2. Расчет тепловых эффектов физических и химических превращений при различных температурах
1. Дайте определение истинной теплоемкости.
2. Какие виды теплоемкостей вы знаете?
3. Запишите выражение для вычисления истинной теплоемкости при постоянном объеме или давлении.
4. Дайте определение удельной и молярной теплоемкости.
5. Напишите формулу для вычисления средней теплоемкости в интервале температур от Т1 до Т2.
6. Выразите взаимосвязь теплоемкости идеальных газов при постоянном давлении Ср и постоянном объеме Сv.
7. Является ли теплоемкость вещества функцией температуры?
8. Как рассчитать изменение теплоемкости в ходе реакции?
9. Каково влияние температуры на тепловой эффект реакции?
10. Запишите закон Кирхгофа в дифференциальной и интегральной формах. Проведите анализ уравнения.
11. Что такое температурный коэффициент реакции?
12. Как изменится тепловой эффект реакции с ростом температуры, если суммарная теплоемкость исходных веществ больше суммарной теплоемкости продуктов реакции и наоборот?
13. Что можно сказать о свойствах участников реакции, если тепловой эффект не зависит от температуры?
14. Проинтегрируйте уравнение Кирхгоффа для случаев приближенного расчета теплового эффекта при заданной температуре (∆Сp = 0, ∆Сp = const).
15. Используя зависимость теплоемкости участников реакции от температуры, проведите интегрирование уравнения Кирхгоффа для точного расчета теплового эффекта при заданной температуре.
Тема 3. Расчет характеристических термодинамических функций
1. Дайте определение абсолютной энтропии и укажите ее свойства.
2. Что такое стандартная энтропия вещества (S0298)?
3. Как рассчитать изменение энтропии чистого вещества: а) при изменении температуры по данным о зависимости теплоемкости от температуры; б) при фазовых превращениях; в) для идеальных газов в различных процессах?
4. Почему для расчета изменения энтропии в необратимых процессах можно воспользоваться уравнениями, выведенными для обратимых процессов?
5. Как произвести расчет изменения энтропии химической реакции в стандартных условиях?
6. В каком случае изменение энтропии является критерием самопроизвольного протекания процесса?
7. Приведите формулу для расчета изменения энтропии химической реакции при различных температурах (∆Сp = const, ∆Сp = f (T)).
8. Дайте определение характеристической термодинамической функции.
9. Какая термодинамическая функция является критерием самопроизвольного протекания процесса при постоянных P и T? Каково значение этой функции в состоянии равновесия?
10. Какая термодинамическая функция является критерием самопроизвольного протекания процесса при постоянных V и T?
11. Каково соотношение между энергией Гиббса и энергией Гельмгольца для термодинамической системы?
12. Как произвести расчет изменения энергии Гиббса и Гельмгольца: а) через стандартные мольные функции Гиббса; б) по значениям ∆H0 и ∆S0.
13. Напишите уравнения зависимости энергий Гиббса и Гельмгольца от температуры и давления.
14. Укажите связь энергий Гиббса и Гельмгольца с полезной работой химических процессов.
15. Что такое химический потенциал? Как связаны между собой свободная энергия системы и химические потенциалы компонентов системы?
