
- •Лабораторная работа № 1 тема: Определения аммония колориметрическим методом с реактивом Несслера.
- •Краткие теоретические сведения.
- •Определение аммиачного азота.
- •Контрольные вопросы.
- •Контрольные вопросы:
- •Почвенная влага. Основные понятия.
- •Водные свойства почвы. Основные понятия.
- •Подготовка проб
- •Ход выполнения работы:
- •Оформление результатов работы.
- •Контрольные вопросы:
- •Лабораторный практикум (почва) Лабораторная работа № 4 тема: Определение общего содержания меди в почве.
- •Колбы конические на 250 мл.
- •Краткие теоретические сведения:
- •Ход выполнения работы:
- •Вычисление результатов измерения.
- •Лабораторная работа № 5 тема: Определение кальция и магния комплексонометрическим методом
- •Краткие теоретические сведения. Определение магния
- •Определение кальция.
- •Ход выполнения работы:
- •Вычисление результатов измерения.
- •Контрольные вопросы:
- •Краткие теоретические сведения.
- •Контрольные вопросы:
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ УКРАИНЫ
СЕВАСТОПОЛЬСКИЙ НАЦИОНАЛЬНЫЙ УНИВЕРСИТЕТ
ЯДЕРНОЙ ЭНЕРГИИ И ПРМЫШЛЕННОСТИ
ОТЧЁТ
ПО ЛАБОРАТОРНОМУ ПРАКТИКУМУ
Студента IV курса
Группы 446
Савенковой Анастасии Александровны
Руководитель практики
______________________
______________________
Проверил
______________________
______________________
Севастополь
2013
СОДЕРЖАНИЕ
I. Почва
Лабораторная работа № 1 «Определение аммония колоритметрическим методом с реактивом Несслера»………………………………………
Лабораторная работа № 2 «Отбор и подготовка проб почвы»…….
Лабораторная работа № 3 «Определение влажности почвы»……..
Лабораторная работа № 4 «Определение общего содержания меди в почве»…………………………………………………………………..
Лабораторная работа № 5 «Определение кальция и магния комплексонометрическим методом»……………………………….
Лабораторная работа № 6 «Определение нефтепродуктов в почве гравиметрическим методом»………………………………………
II. Вода
Лабораторная работа № 1 «Определение ионов аммония в природных и сточных водах»………………………………………………………..
Лабораторная работа № 2 «Определение ионов меди с помощью трилонометрии»………………………………………………………..
Лабораторная работа № 3 «Определение ионов никеля с помощью трилонометрии»…………………………………………………………..
Лабораторная работа № 4 «Определение фосфатов-ионов в природных и сточных водах»…………………………………………………………………..
Лабораторный практикум (почва)
Лабораторная работа № 1 тема: Определения аммония колориметрическим методом с реактивом Несслера.
Цель работы: научиться определять аммоний калориметрическим методом с реактивом Несслера.
Аппаратура, материалы и реактивы.
Фотоэлектроколориметр. ФЭК – 2.
Аналитические весы и технические весы.
Ротатор.
Сушильный шкаф.
Мерные колбы на 50 мл и 1000 мл.
Колбы конические на 250 мл.
Химические стаканы на 50 мл
Воронки Ø 12-14 см.
Фильтр обеззоленые d – 12 см.
Краткие теоретические сведения.
Непосредственно доступными для питания растений являются минеральные соединения азота - аммиачные соли и нитраты. Солей азотистой кислоты - нитритов в почве мало и роль их в питании растений недостаточно выявлена. По некоторым данным, нитриты вредны для растений.
Аммиачные соли и нитраты растворимы в воде и могут быть извлечены из почвы водными вытяжками. Катион NH4+, в отличие от аниона NO3-, энергично поглощается почвой и потому обычно аммиачный азот определяют в солевой вытяжке. В солевую вытяжку переходит не только поглощенный аммоний, но и водорастворимый , который составляет только часть (при том небольшую) поглощенного аммония.
Содержание аммонийного и нитратного азота в почве весьма динамично и во многом зависит от микробиологической деятельности. Поэтому судить об обеспеченности почв азотом по единичному определению нет возможности, и лишь повторные определения в течение вегетационного периода дают представление об азотном режиме почвы. Этим объясняется то, что показатели обеспеченности почв по данным определения аммиачного и нитратного азота отсутствуют. Показателями обеспеченности почв азотом служат данные, получаемые путем определения азота легкогидролизуемых органических соединений почвы.
Определение аммиачного азота.
Аммиачный азот извлекают из почвы 2 %-ным раствором КС1. В вытяжку переходит аммоний, находящийся в обменном состоянии, а также аммоний растворимых в воде аммонийных солей. Поскольку аммоний водорастворимых солей составляет лишь небольшую часть азота, переходящего в солевую вытяжку, считают этот метод методом определения обменного аммония.
Результаты определения обменного аммония служат показателем обеспеченности почв аммиачным азотом.
В полученной вытяжке определяют NH4+ колориметрическим методом Несслера.
Реактивы.
1.Дистиллированная вода без аммиака. К дистиллированной воде прибавляют х.ч. соду до слабощелочной реакции и упаривают раствор до ¼ объема, или используют бидистилят.
2. КС1 2 % раствор, 2 гр. Хлористого калия растворяют в безаммиачной воде и доводят объем раствора до 100 мл.
3.Сегнетовая соль (калий натрий виннокислый) – 50 г соли растворяют в 100 мл безаммиачной дистиллированной воде.
4.Основной эталонный раствор аммония хлористого: 0,3820 г высушенного до постоянного веса при t = 105 0С. хлористого аммония помещают в мерную колбу на 1 л растворяют в небольшом количестве безаммиачной воды и доводят раствор до метки. В 1 мл раствора содержится 0,1 мг NH4+.
5.Рабочий эталонный раствор аммония хлористого – основной раствор разбавляют в 10 раз. В 1 мл раствора содержится 0,01 мг NH4+.
Построение калибровочного графика.
В мерные колбы на 50 мл внести небольшое количество дистиллированной воды и 0, 1, 2, 5, 10, 15, 20 мл рабочего эталонного стандартного раствора аммония хлористого, прибавить 2 мл Сегнетовой соли перемешать, затем добавить 2 мл реактива Несслера довести до метки дистиллированной водой и перемешать.
Приготовленные растворы содержат концентрацию 0; 0,0002; 0,0004; 0,001; 0,002; 0,003 и т.д. мг NH4 в 1 мл.
Через 3 мин раствор колориметрируют на ФЭКе длина волны 425 нм в кювете 10 мм.
Одновременно ставят холостую пробу.
Строят калибровочный график, на оси ординат откладывают значение оптической плотности раствора, по оси абсцисс – концентрацию раствора NH4 в мг/мл.

1, 2, 3 - точки для построения градуировочной прямой.
Подготовка проб.
1.10 г сырой почвы помещают в коническую колбу на 250 мл и заливают 100 мл 2 % раствором КС1, колбы встряхивают в течение часа.
2.Содержимое колбы фильтруют через, предварительно промытым хлористым калием, фильтр.
3.Первые мутные порции фильтрата отфильтровать через тот же фильтр. Для анализа собирают только прозрачный раствор. измерить и записать общий объем фильтрата.
4.Одновременно фильтруют контрольную пробу (100 мл 2 % р-ра КС1) на чистоту реактива и фильтров.
Ход выполнения работы.
В мерную колбу на 50 мл внести 5 мл вытяжки, добавить небольшое количество дистиллированной воды, 2 мл сегнетовой соли перемешать, добавить 2 мл реактива Несслера и довести до метки дистиллированной водой, перемешать. Также обработать и холостую пробу. Колориметрируют через 3 мин.
Окраска должна быть желтой или светлого оттенка. Если раствор приобретает оранжевый или красноватый цвет анализ повторяют, беря меньший объем вытяжки.
Вычисление результатов измерения :
1.Содержания NH4+в мг на 1 г сухой почвы.
Х
=
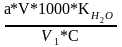
Где: а – концентрация NH4+ найденная по калибровочному графику мг/мл;
V – общий объем вытяжки;
1000 – величина для пересчета на 1 кг почвы.
V1 – объем вытяжки взятой для определения;
С – навеска почвы;
КН2О – коэффициент гигроскопичности.
2.Коэффициент гигроскопичности влаги вычисляют по формуле:
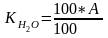
Где : А – гигроскопическая влажность (в %)
Гидроскопическую влажность (А) вычисляют по формуле:
А
=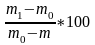
Где: m1 – масса влажной почвы, г;
m0 – масса высушенной почвы, г;
m – масса пустого стаканчика, г;
А
=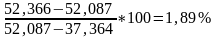
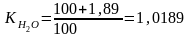
Х
=
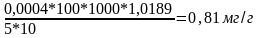
Результаты работы заносятся в таблицу:
№ п/п |
Проба |
Вес навески, С (г) |
Кол-во рабочего стандартного раствора, (мл) |
Кол-во рабочего стандартного раствора, (мг/мл) |
Общий объем вытяжки V (мл) |
Объем вытяжки взятой для определения, V1 (мл) |
Оптическая плотность, Д |
Концентрация NH4+ найденная по калибровочному графику, Q (мг/мл) |
Содержание иона аммония, А мг/кг |
1 |
1 |
10 |
1 |
0.0002 |
|
|
0.037 |
|
О.89 |
2 |
2 |
10 |
5 |
0.0001 |
|
|
0.197 |
|
|
3 |
3 |
10 |
10 |
0.002 |
|
|
0.398 |
|
|
4 |
4 |
10 |
|
|
100 |
5 |
0.094 |
0.0004 |
Вывод.
Непосредственно доступными для питания растений являются минеральные соединения азота - аммиачные соли и нитраты. Общие запасы азота в пахотном слое зависят от типа почв. Основная масса азота содержится в органическом веществе почвы, которое состоит из гумусовых и негумифицированных веществ растительного и животного происхождения. В одной тонне гумуса содержится от 30 до 60 кг азота. Лишь незначительная часть азота входит в состав неорганических соединений в нитратной и аммонийной формах, способной усваиваться растениями.
Аммиачный азот извлекают из почвы 2 %-ным раствором КС1. Поскольку аммоний водорастворимых солей составляет лишь небольшую часть азота, переходящего в солевую вытяжку, считают этот метод методом определения обменного аммония. Результаты определения обменного аммония служат показателем обеспеченности почв аммиачным азотом. В данной лабораторной работе определили NH4+ колориметрическим методом с реактивом Несслера .В данной работе использовали образец песчаных и супесчаных почв, расположенных в северной стороне г.Севастополя в районе «Интернат». По результатам произведённых расчетов , в данном образце почвы, содержание ионов аммония составило А=0.89(мг/кг).Поскольку запасы азота в песчаных и супесчаных почв составляют 0.9 - 2 (т/га),следует вывод, что данный образец почвы имеет допустимое содержание ионов аммония для растений, произрастающих на данной почве.
