
- •1Вопрос Основные положения теории химического строения а.М. Бутлерова
- •2 Вопрос. Предельные углеводороды
- •Химические свойства
- •Способы получения циклоалканов
- •Алгоритм составления названий предельных углеводородов
- •2.3.1.Прямое галогенирование углеводородов.
- •13 Аминокислоты: классификация, номенклатура, физические и химические св-ва,практическое применение.
- •Некоторые важнейшие a-аминокислоты общей формулы
- •Применение
- •Химические свойства
- •Применение
- •33. Органические соединения, содержащие серу: классификация, получение, свойства, применение
- •15 ВопросХимические свойства белков
- •21 Вопрос. Жиры и масла. Получение ,гидролиз и гидрогенизация жиров.
- •Вопрос 22.Карбоновые кислоты ароматического ряда: получение ,свойство ,применение.
- •25.Нитросоединения
- •20 Вопрос.Высокомолекулярные соединения.
- •27 Вопрос
- •Физические свойства спиртов.
- •30 Вопрос.Ароматические альдегиды и кетоны
- •3.Амины.
- •4.Арены
- •28. Органические соединения содержащие кремний.
27 Вопрос
1я группа
Эти соединения обычно представляют собой бесцветные порошкообразные, иногда микрокристаллические вещества, чрезвычайно легко окисляющиеся, на воздухе самовоспламеняющиеся, бурно, иногда со взрывом, реагирующие с водой.
Как показал П. П. Шорыгин, натрийалкилы являются промежуточными продуктами в реакции Вюрца (см. также реакцию Вюрца—Фиттига):
Натрийалкилы реагируют даже с простыми эфирами:
Аналогичны натрийорганическим соединениям по свойствам и поведению литийорганические соединения, которые в последние годы употребляются вместо магнийорганических соединений там, где надо применить более энергично действующий реагент. Изорганических соединений других металлов первой группы получены соединения калия, цезия, рубидия и даже крайне непрочное соединение одновалентной меди C2H5Cu.
Этиллитий C2H5Li образует прозрачные, растворимые в бензоле шестиугольные таблички с т. пл. 95° С.
2я Группа
Для металлов второй группы возможны как симметрические полные металлоорганические соединения, так и смешанные. Последние обычно представляют собой неперегоняющиеся вещества, способные (например, в случае магния) давать кристаллические соединения с эфирами. В этой группе наиболее важны смешанные магнийорганические соединения, применяемые для различных реакций в виде эфирных растворов, а также цинкорганические соединения.
5.Непредельные углеводороды — углеводороды с открытой цепью, в молекулах которых между атомами углерода имеются двойные или тройные связи. Непредельные углеводороды способны к реакциям присоединения по двойным и тройным связям в открытой цепи. Они, например, присоединяют бром, легко окисляются растворомперманганата калия. Для многих непредельных углеводородов характерны реакции полимеризации. К непредельным углеводородам принадлежит несколько гомологических рядов: этилена (алкены), ацетилена (алкины), диены.
Алкенами называются углеводороды с двойной связью. Гомо-
логический ряд алкенов начинается этиленом (по номенклатуре
ИЮПАК— этеном):
CH2 CH2 C2H4 этилен (этен)
CH2 CH CH3 или C3H6 пропилен (пропен)
CH2 CH CH2 CH3 или C4H8 бутен-1
CH2 CH CH2 CH2 CH3 или C5H10 пентен-1
и т. д.
В молекулах алкенов только одна двойная связь. В этом слу-
чае атомов водорода ровно вдвое больше, чем атомов углерода,
поэтому общая формула гомологического ряда алкенов CnH2n. Если
двойных связей две, три или больше, такие соединения выделяют
в отдельные классы диенов, триенов и т. д. (в общем случае —
полиенов). Химические свойства полиенов обычно отличаются от
свойств алкенов, поскольку двойные связи способны влиять друг
на друга — в этом мы убедимся уже в следующем параграфе.
Изомерия алкенов более разнообразна по сравнению с алканами,
и причина тому — наличие двойной связи. К изомерии углеродного
скелета добавляется изомерия положения кратной связи.
алкены-1 образуют гомологический ряд, в ко-
тором наблюдается закономерное изменение физических свойств по
мере увеличения длины цепи. Гомологической разностью является
фрагмент СН2.
способы
введения двойной связи в остовы углеводородов.
1. Термический крекинг алканов. Этот способ используется
в промышленности. Газообразныеалканы, разбавленные водяным
паром, пропускают через нагретые трубки при температуре около
800◦С. Время пребывания реагентов в реакторе-трубке должно быть
очень небольшим, иначе образующиеся продукты вступят в даль-
нейшие реакции. Крекинг протекает по радикальному механизму.
При крекинге происходят реакции разрыва связей СС и дегид-
Рирования
2. Взаимодействие галогеналканов со спиртовымраство-
ром щелочи или дегидрогалогенирование. «Гидрогалогены»— это
переиначенное название галогенводородов НХ, где Х — F, Cl, Br, I.
Следовательно, дегидрогалогенирвание — это отщепление атома га-
логена и атома Н из соединений типа R Х (галогеналканов) под
действием спиртового (но не водного!) раствора щелочи.
Физические свойства
Этен (этилен) СН2 = СН2, - бесцветный газ со слабым запахом;
ЭТИЛЕН (этен)
СН2 = СН2, мол. м. 28,05; бесцв. газ со
слабым запахом; т. пл. -169,15 °С, т. кип.
-103,71 °С;![]() 0,566;
tкрит 9,2 °С, ркрит 5,042 МПа;
0,566;
tкрит 9,2 °С, ркрит 5,042 МПа;![]() (жидкости)
0,161 мПа х с;
(жидкости)
0,161 мПа х с;![]() (жидкости)
16,4 мН/м; давление пара (кПа): 4110
(0 °С), 2200 (-25 °С), 151 (-100 °С); Ср 62,16
Дж/(моль х К) (-193 °С);
(жидкости)
16,4 мН/м; давление пара (кПа): 4110
(0 °С), 2200 (-25 °С), 151 (-100 °С); Ср 62,16
Дж/(моль х К) (-193 °С);![]() -1400
кДж/моль. Р-римость (мл в 100 мл р-рителя
при О °С): вода 25,6, этанол 359;
хорошо раств. в диэтиловом
эфире и углеводородах.
В
природе этилен практически не встречается.
В незначит. кол-вах образуется
в тканях растений и животных как
промежут. продукт обмена в-в. Он обладает
св-вамифитогормонов - замедляет рост,
ускоряет старение клеток, созревание
и опадение плодов.
По хим. св-вам
- типичный представитель олефинов,
обладает высокой реакционной
способностью, особенно в р-цияхэлектроф.
присоединения. При взаимод. этилена
с хлором образуется дихлорэтан,
к-рый при дегидрохлорировании превращается
в винилхлорид; последний м. б. получен
в одну стадию в присут. силицида кремния при
450-550 °С. Гидратация этилена приводит
к этиловому спирту, гидрогалогенирование -
к этилхлориду, взаимод. с SC12 или
S2C12 -
к иприту S(CH2CH2C1)2, окислениекислородом или воздухом в
присут. оксида Ag при 200-300 °С -
к этиленоксиду; жидкофазное окисление кислородом в
водных р-рах PdCl2 и СиС12 при 130 °С и
0,3 МПа - к ацетальдегиду; в тех же
условиях в присут. СН3СООН
образуется винилацетат.
Этилен-
алкилирующий агент, широко используется
для алкилирования бензола; р-цию
проводят в газовой фазе при 400-450 °С
и давлении 1,4 МПа в присут. А1С13 в
стационарном слое кизельгура, пропитанного
Н3РО4 (возможно использование
BF3 и цеолитов).
Этилен- исходное
соед. для получения полиэтилена высокого
и низкого давления и олигомеров этилена,
являющихся основой ряда синтетич. смазочных
масел.Сополимеризацией этилена
с пропиленом на катализаторах
Циглера-Натты получают этилен-пропиленовые
каучуки, обладающие повышенной
устойчивостью кокислению и истиранию.
В пром-сти получают также сополимеры
этилена со стиролом и винилацетатом.
Осн.
метод получения этилена - пиролиз жидких
дистиллятов нефти или низших
парафиновых углеводородов. Р-цию
обычно проводят в трубчатых печах при
750-900 °Сидавлении 0,3 МПа. В России,
Западной Европе и Японии сырьем служит
прямогонный бензин; выход этилена
ок. 30% с одновременным образованием
значит.кол-ва жидких продуктов, в том
числе ароматич. углеводородов.
При пиролизе газойля выход
этилена 15-25%. В США осн. сырье -
легкие алканы (этан, пропан, бутан),
что обусловлено их высоким содержанием
в прир. газе месторождений Северной
Америки; выход этилена ок. 50%.
Разработан
метод получения этилена из метана:
2СН4
-1400
кДж/моль. Р-римость (мл в 100 мл р-рителя
при О °С): вода 25,6, этанол 359;
хорошо раств. в диэтиловом
эфире и углеводородах.
В
природе этилен практически не встречается.
В незначит. кол-вах образуется
в тканях растений и животных как
промежут. продукт обмена в-в. Он обладает
св-вамифитогормонов - замедляет рост,
ускоряет старение клеток, созревание
и опадение плодов.
По хим. св-вам
- типичный представитель олефинов,
обладает высокой реакционной
способностью, особенно в р-цияхэлектроф.
присоединения. При взаимод. этилена
с хлором образуется дихлорэтан,
к-рый при дегидрохлорировании превращается
в винилхлорид; последний м. б. получен
в одну стадию в присут. силицида кремния при
450-550 °С. Гидратация этилена приводит
к этиловому спирту, гидрогалогенирование -
к этилхлориду, взаимод. с SC12 или
S2C12 -
к иприту S(CH2CH2C1)2, окислениекислородом или воздухом в
присут. оксида Ag при 200-300 °С -
к этиленоксиду; жидкофазное окисление кислородом в
водных р-рах PdCl2 и СиС12 при 130 °С и
0,3 МПа - к ацетальдегиду; в тех же
условиях в присут. СН3СООН
образуется винилацетат.
Этилен-
алкилирующий агент, широко используется
для алкилирования бензола; р-цию
проводят в газовой фазе при 400-450 °С
и давлении 1,4 МПа в присут. А1С13 в
стационарном слое кизельгура, пропитанного
Н3РО4 (возможно использование
BF3 и цеолитов).
Этилен- исходное
соед. для получения полиэтилена высокого
и низкого давления и олигомеров этилена,
являющихся основой ряда синтетич. смазочных
масел.Сополимеризацией этилена
с пропиленом на катализаторах
Циглера-Натты получают этилен-пропиленовые
каучуки, обладающие повышенной
устойчивостью кокислению и истиранию.
В пром-сти получают также сополимеры
этилена со стиролом и винилацетатом.
Осн.
метод получения этилена - пиролиз жидких
дистиллятов нефти или низших
парафиновых углеводородов. Р-цию
обычно проводят в трубчатых печах при
750-900 °Сидавлении 0,3 МПа. В России,
Западной Европе и Японии сырьем служит
прямогонный бензин; выход этилена
ок. 30% с одновременным образованием
значит.кол-ва жидких продуктов, в том
числе ароматич. углеводородов.
При пиролизе газойля выход
этилена 15-25%. В США осн. сырье -
легкие алканы (этан, пропан, бутан),
что обусловлено их высоким содержанием
в прир. газе месторождений Северной
Америки; выход этилена ок. 50%.
Разработан
метод получения этилена из метана:
2СН4![]() С2Н4 +
Н2; р-цию проводят на оксидах Mn, Tl,
Cd или Рb при 500-900 °С в
присут. кислорода. Газы пиролизаразделяют
дробной абсорбцией, глубоким
охлаждением и ректификацией под давлением.
Наиб. чистый этилен
получают дегидратацией этанола при
400-450 °С над А12О3; этот метод пригоден для
лаб. получения этилена.
Применяют
этилен в пром. орг. синтезе (в ряде
процессов он вытесняет ацетилен), а
также как регулятор роста растений,
для ускорения созревания плодов,
дефолиации растений и снижения
преждевременного опадания плодов.
Этилен
взрывоопасен, КПВ 3-34% (по объему), т. всп.
136,1 °С, т. самовоспл. 540 °С, ПДК в
атм. воздухе 3 мг/м3, в воздухе рабочей
зоны 100 мг/м3.
С2Н4 +
Н2; р-цию проводят на оксидах Mn, Tl,
Cd или Рb при 500-900 °С в
присут. кислорода. Газы пиролизаразделяют
дробной абсорбцией, глубоким
охлаждением и ректификацией под давлением.
Наиб. чистый этилен
получают дегидратацией этанола при
400-450 °С над А12О3; этот метод пригоден для
лаб. получения этилена.
Применяют
этилен в пром. орг. синтезе (в ряде
процессов он вытесняет ацетилен), а
также как регулятор роста растений,
для ускорения созревания плодов,
дефолиации растений и снижения
преждевременного опадания плодов.
Этилен
взрывоопасен, КПВ 3-34% (по объему), т. всп.
136,1 °С, т. самовоспл. 540 °С, ПДК в
атм. воздухе 3 мг/м3, в воздухе рабочей
зоны 100 мг/м3.
6.Спирты́ (от лат. spiritus — дух; устар. алкого́ли) — органические соединения, содержащие одну или более гидроксильных групп(гидроксил, −OH), непосредственно связанных с насыщенным (находящемся в состоянии sp³ гибридизации) атомом углерода[1]. Спирты можно рассматривать как производные воды (H−O−H), в которых один атом водорода замещен на органическуюфункциональную группу: R−O−H.
Классификация спиртов
Спирты классифицируются следующим образом (в скобках приведены примеры)[5]:
По числу гидроксильных групп:
— одноатомные спирты (метанол); — двухатомные спирты (этиленгликоль); — трехатомные спирты (глицерин); — четырёхатомные спирты (пентаэритрит); — многоатомные спирты (пятиатомный спирт: ксилит). |
|
|
трёхатомный спирт глицерин |
четырёхатомный спирт пентаэритрит |
В зависимости от насыщенности углеводородного заместителя:
— предельные или насыщенные спирты (бутанол); — непредельные или ненасыщенные спирты (аллиловый спирт, пропаргиловый спирт); — ароматические спирты (бензиловый спирт). |
|
В зависимости от наличия или отсутствия цикла в углеводородном заместителе:
— алициклические спирты (циклогексанол); — алифатические или ациклические спирты (этанол). |
|
В зависимости от того, при каком атоме углерода находится гидроксильная группа:
— первичные спирты (пропанол); — вторичные спирты (изопропиловый спирт); — третичные спирты (2-метилпропан-2-ол). |
Изомерия спиртов
Для спиртов характерна структурная изомерия:
изомерия положения ОН-группы (начиная с С3); например:
![]()
углеродного скелета (начиная с С4); например, формуле C4H9OH соответствует 4 структурных изомера:
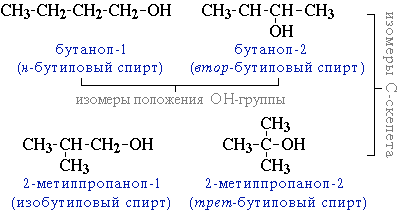
межклассовая изомерия с простыми эфирами (например, этиловый спирт СН3CH2–OH и диметиловый эфир CH3–O–CH3).
Возможна также пространственная изомерия - оптическая (зеркальная) Например, бутанол-2 СH3CH(OH)СH2CH3, в молекуле которого второй атом углерода (выделен цветом) связан с четырьмя различными заместителями, существует в форме двух зеркальных изомеров. Таким образом, формуле C4H9OH соответствует 5 изомерных спиртов (4 структурных изомера и один из них - бутанол-2 - в виде двух зеркальных изомеров).
