
- •1.Классификация по типу превращения субстрата
- •2.Классификация по типу активирования.
- •3.Классификация по характеру разрыва связей.
- •4.Одноэлектронные реакции
- •1. Природные источники.
- •4. Способы получения (методы синтеза).
- •5. Химические свойства.
- •2. Перициклические реакции.
- •Металлоорганический синтез.
- •Гидрирование бензола и его гомологов.
- •Пиролиз солей дикарбоновых кислот.
- •Дегалогенирование вицинальных дигалогеналканов.
- •Реакция Виттига.
- •Дегидрирование и крекинг алканов.
- •Дегидратация спиртов (элиминирование).
- •Дегидрогалогенирование галогеналканов.
- •Галогенирование алкенов.
- •Гидрогалогенирование.
- •Гидратация.
- •4. Присоединение спиртов.
- •5. Оксимеркурирование.
- •6. Гидроборирование.
- •7. Присоединение хлорноватистой кислоты.
- •8. Окисление.
- •Карбидный способ.
- •Пиролиз этилена и метана.
- •Дегалогенирование дигалогеннидов и галогеналкенов.
- •Гидролиз
- •1. Галогенангидриды
- •Ацилирование хлорангидридами
- •Восстановление хлорангидридов
- •2.Ангидриды карбоновых кислот
- •3.Сложные эфиры
- •Нитрилы
- •Альдегидо- и кетокислоты.
- •Строение и таутомерия ацетоуксусного эфира
- •Нитросоединения
- •Восстановление нитросоединений
- •2. Действие азотистой кислоты.
- •Реакция анри ( конденсация нитроалканов с альдегидами)
- •Диазосоединения
- •Элементорганические соединения
- •Активные металлоорганические соединения
- •I , II и III групп
- •Вторая группа периодической системы
- •Третья группа периодической системы
- •Четвертая группа периодической системы
- •Пятая группа периодической системы
- •Аминокислоты. Белки.
- •Пятичленные гетероциклы с одним гетероатомом и их производные.
- •Шестичленные и конденсированные гетероциклические соединения. Алкалоиды.
- •Серосодержащие органические соединения
Дегалогенирование вицинальных дигалогеналканов.
Приставка виц- означает, что заместители находятся при соседних атомах углерода.
Эту реакцию, как правило проводят действием Zn-пыли на 1,2-дигалогеналкан в спиртовом или уксуснокислом растворе.
R-CH-CH2
![]() >
R-CH=CH2
+ ZnCl2
>
R-CH=CH2
+ ZnCl2
Cl Cl
Восстановление ацетиленовых углеводородов и диенов.
Эти реакции требуют применения специальных катализаторов. В качестве катализатора применяют металлы: Pd, Pt, Ni. С этими катализаторами реакция протекает быстрее. Катализатор , состоящий из палладия, оксида или ацетата свинца и карбоната кальция , носит название «катализатор Линдлара».
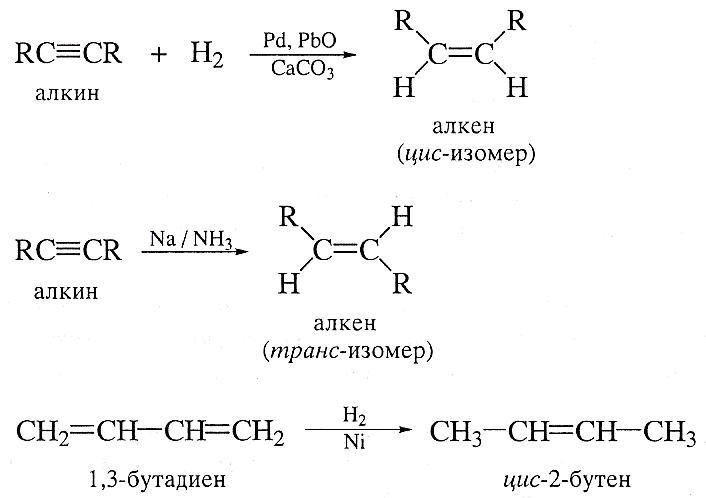
Реакция Виттига.
Эта реакция протекает через образование промежуточного циклического соединения и заключается в замене карбонильного кислорода в альдегидах и кетонах на метильную группу при помощи фосфинметиленов:

Дегидрирование и крекинг алканов.
Дегидрирование алканов служит основным источником алкенов в промышленности.
В качестве катализатора применяют триоксид хрома.
Процесс проводят при высокой температуре (до 4500С):

Крекинг алканов проводят при более высокой температуре. Этот процесс протекает менее однозначно:
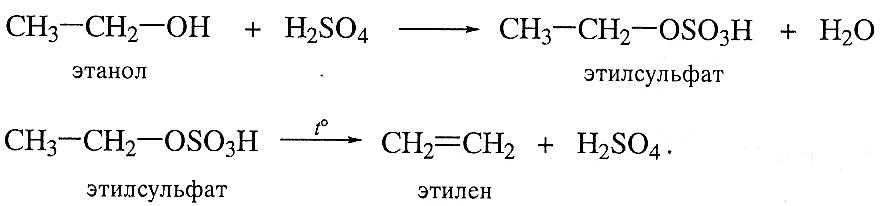
Дегидратация спиртов (элиминирование).
Отщепление воды от спиртов приводят нагреванием спирта при высокой температуре в присутствии сильных минеральных кислот (серной, фосфорной). При этом сначала образуется сложный эфир, который наряду с этиленом дает молекулу кислоты. Дегидратацию этанола ведут при 1800С.
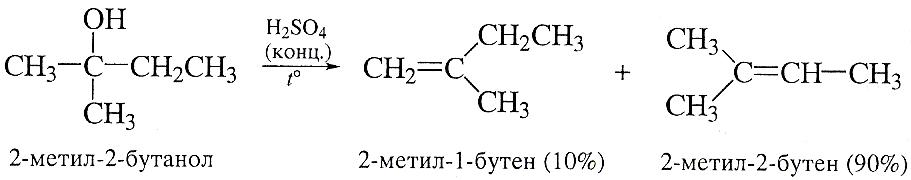
Дегидратацию гомологов этанола проводят при более низкой температуре. Если возможно получение нескольких изомеров, то преимущественно образуется более замещенный алкен:
По другому способу спирт пропускают в парах над твердым катализатором (оксиды алюминия, тория, вольфрама). Температура при этом достигает 300-3500С, а выход алкена приближается к 100%:

Дегидрогалогенирование галогеналканов.

ХИМИЧЕСКИЕ СВОЙСТВА.
Галогенирование алкенов.
Галогенирование алкенов проводят в присутствии инициаторов радикальных реакций: для этого применяют четыреххлористый углерод или хлороформ:
CH2=CH2
+ Br2
![]() CH2-
CH2
CH2-
CH2
Br Br
Смещанные галогены присоединяются к алкенам в соответствии с поляризацией связи Hal-Hal:
CH3 CH3
C=CH2 + J→Cl → CH3- C - CH2
CH3 Cl J
При более высоких температурах (выше 4000С), взаимодействие гомологов этилена ведет к замещению атомов водорода в аллильном положении на галоген.
СН2=СH
–CH2-CH3
+ Cl2
![]() >
CH2=CH-CH-CH3
+ CH2-CH=CH-CH3
>
CH2=CH-CH-CH3
+ CH2-CH=CH-CH3
аллильный углерод Cl Cl
Гидрогалогенирование.
Гидрогалогенированием называют присоединение галогенводорода по кратной связи. При проведении реакции применяют различные растворители: пентан, бензол, дихлорметан, хлороформ, уксусная кислота. Чаще других в качестве галогенводорода используют бромоводород.
Реакции гидрогалогенирования несимметричных алкенов отличаются высокой регионселективностью и может идти по двум направлениям: по правилу Марковникова и против этого правила.
Br
R-CH-CH3 2-бромалкан (по правилу )
R-CH=CH2 + HBr
R-CH2-CH2 1-бромалкан (против правила)
Br
Правила Марковникова: при присоединении к несимметричному алкену протон реагента преимущественно присоединяется к наиболее гидрогенизированному (имеющему большее число атомов водорода) атому углерода.
При наличии рядом с двойной связью электроноакцепторного заместителя, либо реакция будет идти в присутствии перекисей, то продукты реакции будут образовываться против правила Марковникова.
NO2-CH=CH2 + HBr → NO2-CH2-CHBr
