
- •1.Классификация по типу превращения субстрата
- •2.Классификация по типу активирования.
- •3.Классификация по характеру разрыва связей.
- •4.Одноэлектронные реакции
- •1. Природные источники.
- •4. Способы получения (методы синтеза).
- •5. Химические свойства.
- •2. Перициклические реакции.
- •Металлоорганический синтез.
- •Гидрирование бензола и его гомологов.
- •Пиролиз солей дикарбоновых кислот.
- •Дегалогенирование вицинальных дигалогеналканов.
- •Реакция Виттига.
- •Дегидрирование и крекинг алканов.
- •Дегидратация спиртов (элиминирование).
- •Дегидрогалогенирование галогеналканов.
- •Галогенирование алкенов.
- •Гидрогалогенирование.
- •Гидратация.
- •4. Присоединение спиртов.
- •5. Оксимеркурирование.
- •6. Гидроборирование.
- •7. Присоединение хлорноватистой кислоты.
- •8. Окисление.
- •Карбидный способ.
- •Пиролиз этилена и метана.
- •Дегалогенирование дигалогеннидов и галогеналкенов.
- •Гидролиз
- •1. Галогенангидриды
- •Ацилирование хлорангидридами
- •Восстановление хлорангидридов
- •2.Ангидриды карбоновых кислот
- •3.Сложные эфиры
- •Нитрилы
- •Альдегидо- и кетокислоты.
- •Строение и таутомерия ацетоуксусного эфира
- •Нитросоединения
- •Восстановление нитросоединений
- •2. Действие азотистой кислоты.
- •Реакция анри ( конденсация нитроалканов с альдегидами)
- •Диазосоединения
- •Элементорганические соединения
- •Активные металлоорганические соединения
- •I , II и III групп
- •Вторая группа периодической системы
- •Третья группа периодической системы
- •Четвертая группа периодической системы
- •Пятая группа периодической системы
- •Аминокислоты. Белки.
- •Пятичленные гетероциклы с одним гетероатомом и их производные.
- •Шестичленные и конденсированные гетероциклические соединения. Алкалоиды.
- •Серосодержащие органические соединения
2. Перициклические реакции.
Сопряженные диены и полиены образуют циклические структуры в ходе внутримолекулярных электроцикличесих реакций, протекающих как при нагревании, так и при фотовозбуждении. Образующиеся циклические углеводороды легко переводят гидрированием в циклоалканы или их производные.

Алкены и алкадиены способны образовывать циклические углеводороды также и в реакциях циклоприсоединения.

Металлоорганический синтез.
Реакции получения алканов с применением металлоорганических реагентов пригоды и в синтезе циклоалканов. В частности дибромалканы реагируют с металлическим натрием по типу реакции Вюрца.

Обработка дибромалканов малоновым эфиром в присутствии этилата натрия является общим методом получения циклоалканкарбоновых кислот (реакция Перкина).
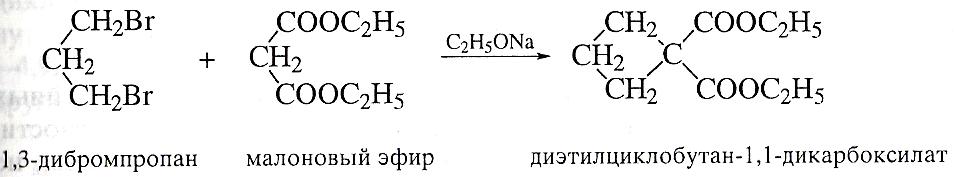
Гидрирование бензола и его гомологов.
Каталитическое гидрирование бензола. Его гомологов и некоторых производных является надежным источником соответствующих циклогексанов.
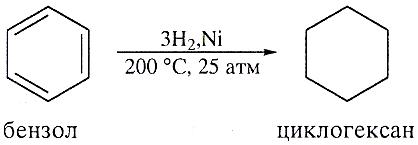
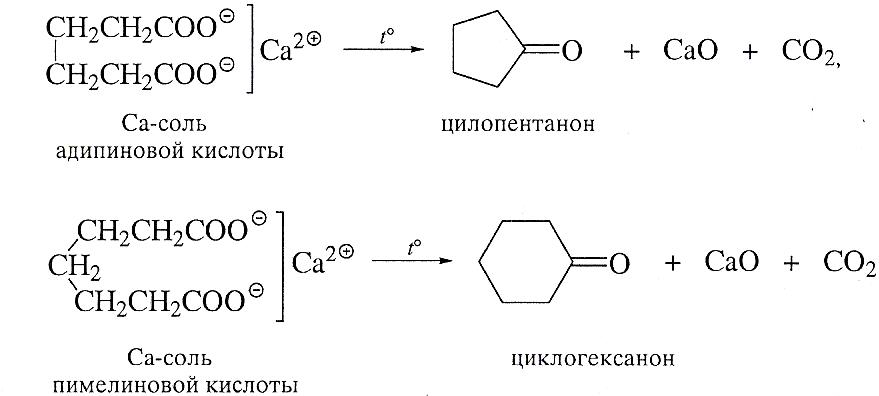
Пиролиз солей дикарбоновых кислот.
Одна из реакций, широко применяемых в синтезе циклоалканов,- реакция циклизации дикарбоновых кислот, содержащих более пяти атомов углерода в молекуле. Кальциевые соли этих кислот при сухой перегонке превращаются в циклоалканоны. Циклоалканоны легко превращаются затем в циклоалканы восстановлением карбонильной группы.
ХИМИЧЕСКИЕ СВОЙСТВА
Реакция с водородом
Эта реакция, как и последующие реакциис электрофильными агентами, протекают неодинаково для различных циклоалканов. Низшие циклоалканы, и прежде всего циклопропан, реагируют с раскрытием цикла. При этом циклопропан проявляет наиболее высокую реакционную способность.

Реакции с минеральными кислотами
Циклоалканы к ионным реагентам относятся также неодинаково. Например, с сильными минеральными кислотами циклопропан реагирует с раскрытием цикла, а средние циклоалканы в реакцию не вступают.

Реакции с галогенами

А Л К Е Н Ы
Ненасыщенные углеводороды, содержащие двойную связь и образующие гомологический ряд общей формулы CnH2n, называют алкенами. Тривиальное название алкенов ( в настоящее время устаревшее)- олефины.
По номенклатуре ИЮПАК название алкена происходит от названия соответствующего алкана заменой суффикса –ан на –ен. Аналогично образуются названия циклоалкенов.
привести формулы: этена, пропена, 2-метилпропена, бутена-2, циклогексена, 4-метил-4-хлор-пентена-2.
Алкены могет существовать в виде геометрических изомеров.
Поскольку фрагменты молекулы алкена не имеют возможности вращаться относительно двойной связи, заместители у углеродных атомов при этой связи могут располагаться как по одну, так и по разные стороны.
Стереоизомеры, различающиеся расположением заместителей относительно двойной связи, называют геометрическими изомерами.
Для обозначения геометрических изомеров применяют две номенклатуры: цис-, транс- и E,Z-.
В соответствии с цис-, транс-номенклатурой геометрические изомеры. В которых заместители расположены по одну сторону относительно двойной связи, называют цис-изомерами.
Геометрические изомеры, в которых заместители расположены по разные стороны относительно двойной связи, называют транс-изомеры.
Также для алкенов характерна изомерия положения двойной связи.
СПОСОБЫ ПОЛУЧЕНИЯ.
