
- •1.Классификация по типу превращения субстрата
- •2.Классификация по типу активирования.
- •3.Классификация по характеру разрыва связей.
- •4.Одноэлектронные реакции
- •1. Природные источники.
- •4. Способы получения (методы синтеза).
- •5. Химические свойства.
- •2. Перициклические реакции.
- •Металлоорганический синтез.
- •Гидрирование бензола и его гомологов.
- •Пиролиз солей дикарбоновых кислот.
- •Дегалогенирование вицинальных дигалогеналканов.
- •Реакция Виттига.
- •Дегидрирование и крекинг алканов.
- •Дегидратация спиртов (элиминирование).
- •Дегидрогалогенирование галогеналканов.
- •Галогенирование алкенов.
- •Гидрогалогенирование.
- •Гидратация.
- •4. Присоединение спиртов.
- •5. Оксимеркурирование.
- •6. Гидроборирование.
- •7. Присоединение хлорноватистой кислоты.
- •8. Окисление.
- •Карбидный способ.
- •Пиролиз этилена и метана.
- •Дегалогенирование дигалогеннидов и галогеналкенов.
- •Гидролиз
- •1. Галогенангидриды
- •Ацилирование хлорангидридами
- •Восстановление хлорангидридов
- •2.Ангидриды карбоновых кислот
- •3.Сложные эфиры
- •Нитрилы
- •Альдегидо- и кетокислоты.
- •Строение и таутомерия ацетоуксусного эфира
- •Нитросоединения
- •Восстановление нитросоединений
- •2. Действие азотистой кислоты.
- •Реакция анри ( конденсация нитроалканов с альдегидами)
- •Диазосоединения
- •Элементорганические соединения
- •Активные металлоорганические соединения
- •I , II и III групп
- •Вторая группа периодической системы
- •Третья группа периодической системы
- •Четвертая группа периодической системы
- •Пятая группа периодической системы
- •Аминокислоты. Белки.
- •Пятичленные гетероциклы с одним гетероатомом и их производные.
- •Шестичленные и конденсированные гетероциклические соединения. Алкалоиды.
- •Серосодержащие органические соединения
4.Одноэлектронные реакции
Своеобразие этих реакций заключается в том, что они не сопровождаются разрывом старых и образованием новых связей. В ходе этих реакций органическая молекула не подвергается заметной трансформации, поскольку она лишь отдает или присоединяет электрон.
Одноэлектронные реакции являются промежуточными стадиями многих процессов. В которых участвуют органические соединения. В частности, отрыв электрона от органической молекулы часто сопровождает реакции электрофильного замещения или окисления.
Отрыв электрона от органической молекулы ведет к образованию катион-радикала: М → М+ + ẻ
нейтральная молекула катион-радикал электрон
Если для отрыва электрона потребовалось минимальное количество энергии,
электрон «уходит» с высшей занятой молекулярной орбитали.
Органическая молекула может не только отдавать, но и присоединять электроны, обладающие различным запасом энергии. Электрон с минимальной энергией «садится» на низшую свободную молекулярную орбиталь. Присоединение электрона к молекуле субстрата наблюдается, например, в реакциях нуклеофильного замещения и восстановления.
Присоединение электрона ведет к образованию анион-радикала:
М + ẻ → М-
нейтральная молекула анион-радикал
Образующиеся в ходе одноэлектронных реакций ион-радикалы являются весьма реакционноспособными частицами и в обычных условиях быстро подвергаются последующим превращениям. Однако, в газовой фазе и при пониженном давлении одноэлектронные реакции можно наблюдать в «чистом» виде. При этом появляется возможность измерения очень важных параметров, характеризующих электронное строение и реакционную способность органических соединений- потенциалов ионизации и электронного сродства.
Электронное сродство- энергия, требуемая для присоединения электрона к молекуле.
А Л К А Н Ы
Молекулы углеводородов состоят только из углерода водорода. Углеводороды наиболее многочисленны среди других классов органических соединений. Их подразделяют на алифатические и ароматические.
Эта классификация сложилась в Х1Хвеке, когда органические соединения получали преимущественно из природных источников. Часть из них выделяли из жиров и масел; такие соединения называли жирными, или алифатическими (от греческого алифа- жир). Другие соединения отличались особым запахом, их назвали ароматическими.
1. Природные источники.
Алканы, находящиеся в природе в составе природного газа, нефти, среди продуктов биологического разложения растительных остатков, являются одним из основных сырьевых источников органического синтеза.
Значительные количества метана содержатся в атмосфере тяжелых планет (Юпитер, Сатурн, Уран, Нептун). Эти планеты имеют восстановительную атмосферу, т.е. богатую водородом. Поэтому и углерод, и азот находятся на них в восстановленной форме: в виде метана и аммиака соответственно. Содержание метана на тяжелых планетах так велико, что были предложены фантастические проекты его транспортировки в далеком будущем на Землю.
Силы притяжения на Земле значительно слабее, что приводит к потере водорода. Поэтому Земля имеет окислительную атмосферу. Тем не менее и на Земле есть значительное количество метана благодаря бактериям- «метаногенам», которые разлагают растительные и животные остатки в отсутствие кислорода. Болотный газ (образующийся при гниении целлюлозы без доступа воздуха), например, на 99% состоит из метана.
Природный газ и нефть в настоящее время являются основным источником алканов в промышленности.
Природный газ особенно богат метаном (его содержание достигает (98%). Газообразные алканы встречаются также в местах нефтяных отложений (попутный газ). Содержание в попутном газе достигает 75-85%. В заметных количествах в попутном газе присутствуют также этан и пропан.
Нефть представляет собой жидкую смесь нескольких сотен углеводородов, половина из которых- алканы и циклоалканы.
Трансформация алканов введением в их молекулы разнообразных функциональных групп и последующие превращения дают химикам возможность получать самые разнообразные продукты.
2. Физические свойства.
Родоначальным углеводородом этого ряда является метан. Все остальные углеводороды, относящиеся к алканам- члены гомологического ряда метана, и, поскольку гомологи отличаются друг от друга на гомологическую разность, состав любого алкана может быть выражен формулой СnH2n+2.
Низшие алканы С1-С4 при комнатной температуре газообразны. Линейные алканы от С5 до С16 являются жидкостями, а высшие- твердыми веществами. Легколетучие жидкие алканы имеют запах бензина. Газообразные и высшие углеводороды на обладают запахом.
С увеличением числа звеньев -СН2- в гомологическом ряду температура кипения алканов увеличивается. Разветвление углеводородной цепи заметно снижает температуру кипения алкана.
Например: н-пентан 360С, 2-метилбутан – 280С, 2,2-диметилпропан – 90С.
Силы притяжения между молекулами алканов имеют природу дисперсионных сил. Силы притяжения такой природы прямо пропорциональны величине поверхности контакта в жидком и твердом состоянии. О весьма малых величинах сил притяжения молекул алканов свидетельствует факт практически полной несмешиваемости алканов с водой.
3. Пространственное строение.
Пространственная структура гомологов метана (sp3-гибридизация) определяется возможностью свободного вращения фрагментов их молекул, соединенных простыми связями, вокруг этих связей. При таком вращении молекула приобретает определенную геометрию (конформацию).
Конформации одного соединения различаются степенью поворота фрагментов молекулы относительно одной или нескольких σ-связей.
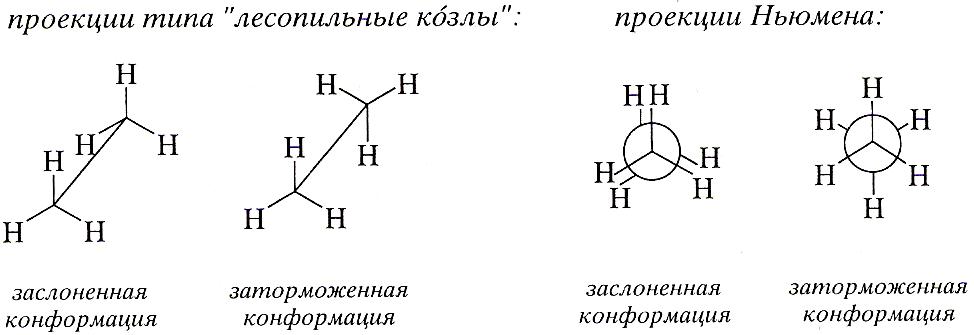
Перспективные проекции (типа «лесопильные козлы») и проекции Ньюмена основаны на тетраэдрической конфигурации атомов углерода в молекулах алканов. При построении этих проекций, выбирают центральную С-С-связь, относительно которой вращаются два фрагмента молекулы. Атомы углерода изображают в виде точек. В проекциях Ньюмена центральная С-С-связь предполагается перпендикулярной плоскости чертежа. Задний атом углерода изображают в виде круга, а передний- в виде точки внутри круга. Эти две конформации этана получили названия «заслоненная» и «заторможенная».
Заслененной конформацией называют конформацию, в которой группы у соседних атомов находятся одна за другой; двугранный угол между заместителями, находящимися у соседних атомов углерода, в этой конформации равен 00.
Заторможенной конформацией называют конформацию с двугранным углом между заместителями у соседних атомов углерода, равным 600.
Изомерия.
Изомерия алканов заключается в основном только в изомерии углеродного скелета (остова).
Если рассмотреть изомеры бутана, пентана и т.д., то можно выделить четыре различных типа связывания атома углерода с другими углеродными атомами.
Первичный атом углерода- тот, который в цепи связан с одним соседним атомом углерода.
Вторичный- связан в цепи с двумя соседними атомами углерода.
Третичный и четвертичный- связаны с тремя и четырьмя (соответственно) атомами углерода в цепи.
привести примеры на доске.
