
- •1.Классификация по типу превращения субстрата
- •2.Классификация по типу активирования.
- •3.Классификация по характеру разрыва связей.
- •4.Одноэлектронные реакции
- •1. Природные источники.
- •4. Способы получения (методы синтеза).
- •5. Химические свойства.
- •2. Перициклические реакции.
- •Металлоорганический синтез.
- •Гидрирование бензола и его гомологов.
- •Пиролиз солей дикарбоновых кислот.
- •Дегалогенирование вицинальных дигалогеналканов.
- •Реакция Виттига.
- •Дегидрирование и крекинг алканов.
- •Дегидратация спиртов (элиминирование).
- •Дегидрогалогенирование галогеналканов.
- •Галогенирование алкенов.
- •Гидрогалогенирование.
- •Гидратация.
- •4. Присоединение спиртов.
- •5. Оксимеркурирование.
- •6. Гидроборирование.
- •7. Присоединение хлорноватистой кислоты.
- •8. Окисление.
- •Карбидный способ.
- •Пиролиз этилена и метана.
- •Дегалогенирование дигалогеннидов и галогеналкенов.
- •Гидролиз
- •1. Галогенангидриды
- •Ацилирование хлорангидридами
- •Восстановление хлорангидридов
- •2.Ангидриды карбоновых кислот
- •3.Сложные эфиры
- •Нитрилы
- •Альдегидо- и кетокислоты.
- •Строение и таутомерия ацетоуксусного эфира
- •Нитросоединения
- •Восстановление нитросоединений
- •2. Действие азотистой кислоты.
- •Реакция анри ( конденсация нитроалканов с альдегидами)
- •Диазосоединения
- •Элементорганические соединения
- •Активные металлоорганические соединения
- •I , II и III групп
- •Вторая группа периодической системы
- •Третья группа периодической системы
- •Четвертая группа периодической системы
- •Пятая группа периодической системы
- •Аминокислоты. Белки.
- •Пятичленные гетероциклы с одним гетероатомом и их производные.
- •Шестичленные и конденсированные гетероциклические соединения. Алкалоиды.
- •Серосодержащие органические соединения
Нитрилы
При образовании названия нитрила карбоновой кислоты по номенклатуре ИЮПАК суффикс –нитрил добавляют к названию углеводорода ( в название углеводорода включают атом углерода группы -C≡N.
СПОСОБЫ ПОЛУЧЕНИЯ
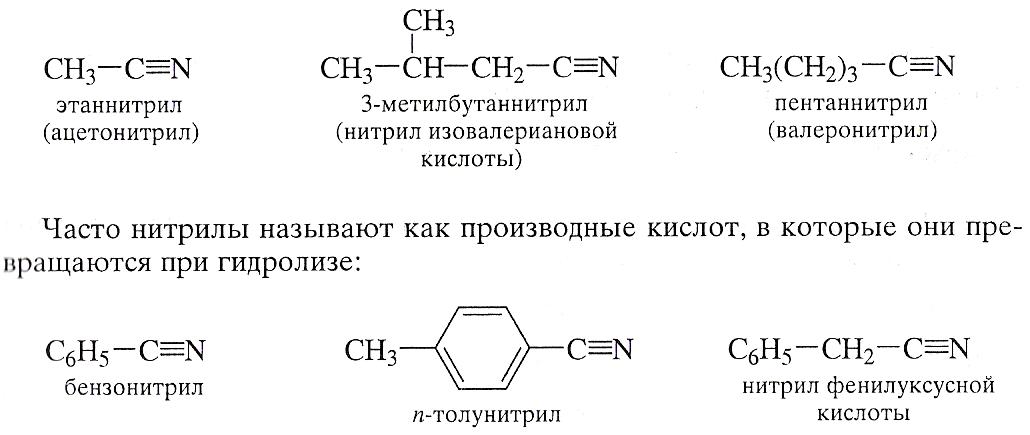
Дегидратация аминов позволяет получить нитрилы как алифитического, так и ароматических карбоновых рядов:
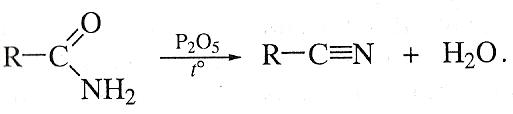
Аммонолиз карбоновых кислот карбоновых кислот также является универсальным методом получения нитрилов и применяется в промышленности.
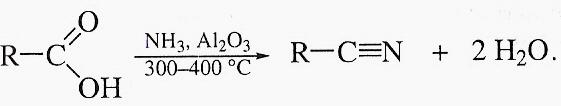
Дегидратация оксимов альдегидов относится к лабораторным методам получения нитрилов.
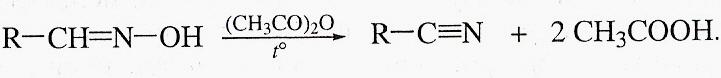
Из галогеналканов можно легко получить нитрилы алифатических карбоновых кислот:
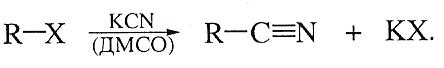
Превращение арендиазониевых солей (реакция Зандмейера)- это надежный источник получения нитрилов ароматических карбоновых кислот:
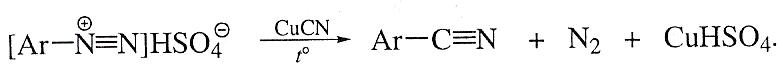
Сплавление арилсульфонатов с цианидом калия:
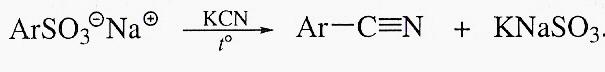
Циангидринный синтез позволяет получить нитрилы α-замещенных карбоновых кислот:
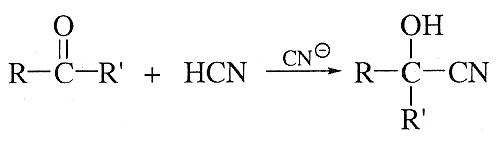
СТРОЕНИЕ
Тройная связь C≡N подобна тройной связи С≡С: атомы углерода и азота нитрильной группы находятся в sp-гибридном состоянии.
Тройная связь C≡N - более прочная, чем тройная связь С≡С и является более полярной.
Нитрилы имеют высокие температуры кипения. Многие нитрилы хорошо растворимы в воде, т.к. образуют водородные связи с молекулами воды. Атом азота нитрильной группы имеет свободную электронную пару. Однако эта пара находится на sp-орбитали, что является очень низкой основности нитрилов.
ХИМИЧЕСКИЕ СВОЙСТВА
Гидролиз нитрилов протекает при нагревании с водными растворами кислот или оснований. При этом промежуточно образуются амиды карбоновых кислот. Рассмотрим реакцию гидролиза до конца- до образования солей кислот:
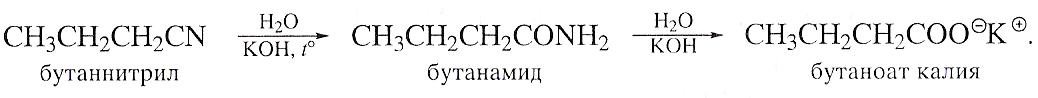
Реакции нитрилов с реагентами Гриньяра.
Эти реакции протекают менее энергично, чем реакции присоединения альдегидов и кетонов. Однако реактив Гриньяра к нитрилу легко присоединяется по месту тройной связи. При этом образуются соли кетемина. При разложении соли разбавленной кислотой образуются кетоны:
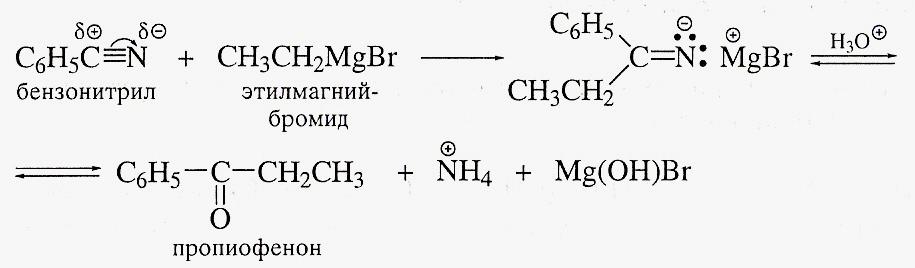
Восстановление нитрилов.
Нитрилы легко восстанавливаются до первичных аминов. В качестве восстановителей применяют литийалюминийгидрид и водород над металлическим никелем:
ГАЛОГЕН- и ГИДРОКСИКАРБОНОВЫЕ
КИСЛОТЫ
В органической химии большое место занимают соединения, которые содержат в молекуле различные функциональные группы. Такие вещества называют соединениями со смешанными функциями. Их можно представить как «химические химеры»: они составлены из частей молекул, принадлежащих к различным классам органических соединений, они проявляют свойства и тех, и других. Кроме того, они обладают своими, особенными свойствами. К этой группе веществ относят гидроксикислоты, аминокислоты, аминоспирты, альдегидо- и кетонокислоты, углеводы.
НОМЕНКЛАТУРА ГИДРОКСИКАРБОНОВЫХ КИСЛОТ
Названия замещенных карбоновых кислот образуют по правилам номенклатуры ИЮПАК. Разберем на примерах- в скобках приведены тривиальные названия.
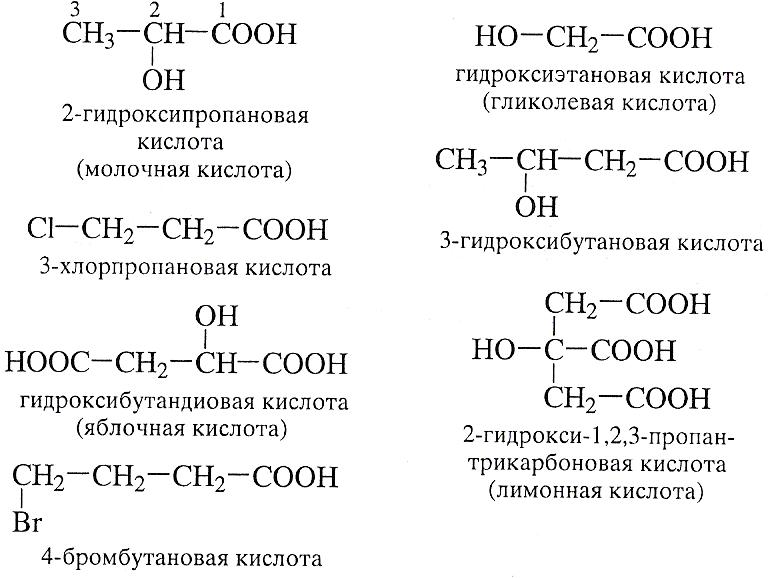
Положение заместителя относительно карбоксильной группы может быть указано с помощью букв греческого алфавита. Различают α─;β─;γ─ и т.д. замещенные кислоты:
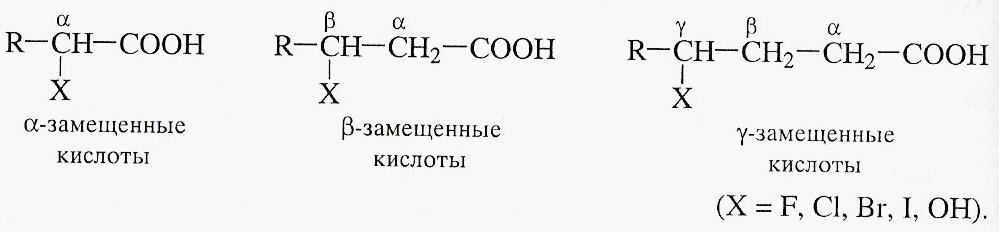
Гидроксикислоты обычно называют тривиальными названиями (молочная, яблочная, лимонная и т.д.)

α- Гидроксикарбоновые кислоты распространены среди природных соединений. Гликолевая кислота является составной частью сиропа, получаемого при выделении тростникового сахара. Молочная кислота ответственна за специфический запах кислого молока. Яблочная кислота встречается во фруктовых соках. Лимонная кислота является исходным компонентом в большинстве метаболических циклов. Β-гидроксимасляная кислота образует полимерный эфир, широко встречающийся в клетках и клеточных мембранах.
КЛАССИФИКАЦИЯ
1. В зависимисти от количества карбоксильных групп различают одно-, двухосновные и т.д. гидроксикислоты.
2. Атомность гидроксикислот определяется числом гидроксильных групп (включая гидроксильную группу, входящую в состав карбоксильной группы)
3. В зависимости от взаимного расположения карбоксильной и гидроксильной групп различают α─;β─;γ─ и δ─гидроксикислоты.
4. По строению углеродного радикала, связанного с гидрокси- и карбоксильной группами, гидроксикислоты могут быть предельными и непредельными.
СПОСОБЫ ПОЛУЧЕНИЯ.
Галогенирование карбоновых кислот в присутствии красного фосфора.
По этой реакции получают α-галогенкарбоновые кислоты. Реакцию α-бромирования карбоновых кислот можно провести и в присутствии PCl3, причем также применив его лишь в каталитических количествах.
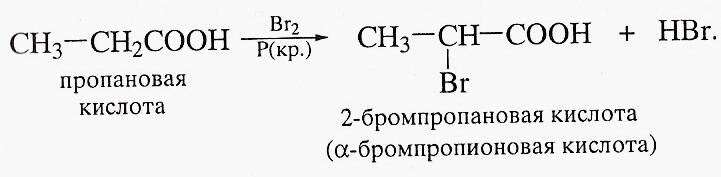
Гидролиз α-галогензамещенных кислот
Гидролиз α-галогенкарбоновых кислот ведет к получению α-гидроксикарбоновых кислот
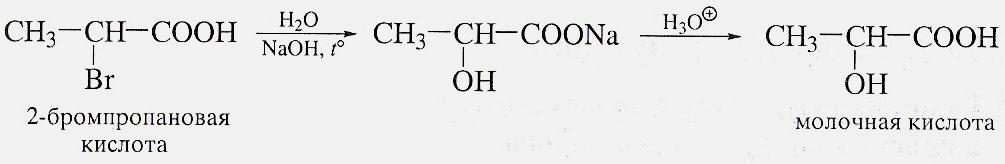
Реакции прсоединения к α-,β-ненасыщенным кислотам
Окисление гликолей:
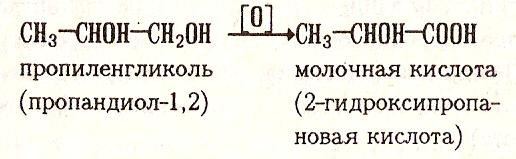
Циангидринный синтез
Из кетонов и альдегидов α-гидроксикислоты получают с промежуточным образованием циангидринов:
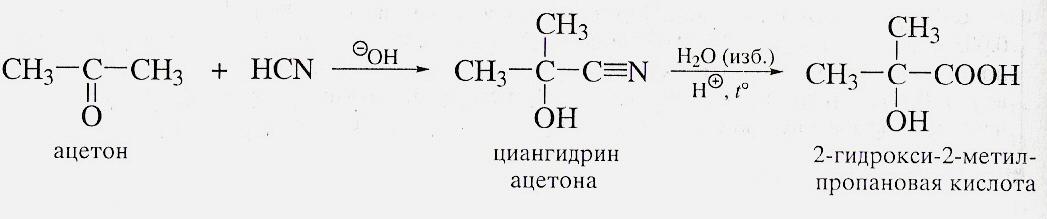
Реакция Реформаторского
Из карбонильных соединений по реакции Реформаторского получают β-гидроксизамещенные кислоты. В ходе реакции промежуточно образуется цинкорганическое соединение:
Восстановление кетонокислот.
Окисление кетоноальдегидов.
Окисление моносахаридов
Окисление непредельных кислот по Вагнеру (н.у.)
акриловая→глицериновая кислота
СТЕРЕОИЗОМЕРИЯ
Структурная изомерия гидроксикислот определяется изомерией углеродной цепи и взаимным расположением спиртовой и карбоксильной групп.
В 1815г французский физик Ж.Био открыл новый вид изомерии- оптическую,или зеркальную. Он обнаружил, что некоторые органические вещества в жидком состоянии или растворенном состоянии вращают плоскость поляризованного света. Этот вид изомерии является частным случаем пространственной изомерии- стереоизомерии (пространственной изомерии)
Замещение атома водорода у α-углеродного атома в карбонильной кислоте на функциональную группу ведет к появлению хирального центра.
Соединения, которые изменяют (вращают) плоскость поляризации, называют оптически активными, и они существуют в виде двух оптических изомеров. Один из них вращает плоскость поляризации вправо, а другой- на тоже угол, но влево. Для обозначения этих вращений используют знаки (+) и (-), которые ставят перед формулой оптического изомера. Изомеры, которые вращают плоскость поляризации в разные стороны, но на один и тотже угол, называют антиподами или энантиомерами ( от греческого: enantio-противоположный).
Все оптически активные вещества содержат в своих молекулах хотя бы один ассиметричный атом углерода- атом углерода, у которого все различные радикалы. Такая система лишена практически всех элементов симметрии.
При взаимодействии с ассиметрическим углеродным атомом, у которого все четыре заместителя отличаются по своему геометрическому и электронному строению, электромагнитная волна «деформируется», что и приводит к повороту плоскости поляризации.
Смесь состоящая
из равных количеств левого и правого
изомеров (антиподов), известна как
рацемическая
смесь, или
рацемат,
и обозначается (![]() )
или буквой (r).
Рацематы образуются при синтезе вещества
в том случае, когда вероятность образования
каждого из оптических антиподов
одинакова. Поэтому рацемическое вещество
оптически неактивно в результате
взаимной компенсации активностей
входящих в него оптических изомеров.
)
или буквой (r).
Рацематы образуются при синтезе вещества
в том случае, когда вероятность образования
каждого из оптических антиподов
одинакова. Поэтому рацемическое вещество
оптически неактивно в результате
взаимной компенсации активностей
входящих в него оптических изомеров.
Любое органическое соединение, содержащее ассиметрический углеродный атом, можно представить в виде двух пространственных форм (моделей), которые при наложении в пространстве не могут быть совмещены друг с другом. Эти две формы (модели) отличаются друг от друга как предмет от своего зеркального изображения. Поэтому такая изомерия получила название «зеркальной».
Молекулы (или модели), которые нельзя совместить в пространстве (при наложении) и которые относятся друг к другу как предмет к своенму зеркальному изображению, называют хиральными ( от греческого хейрос- рука, рукоподобие).
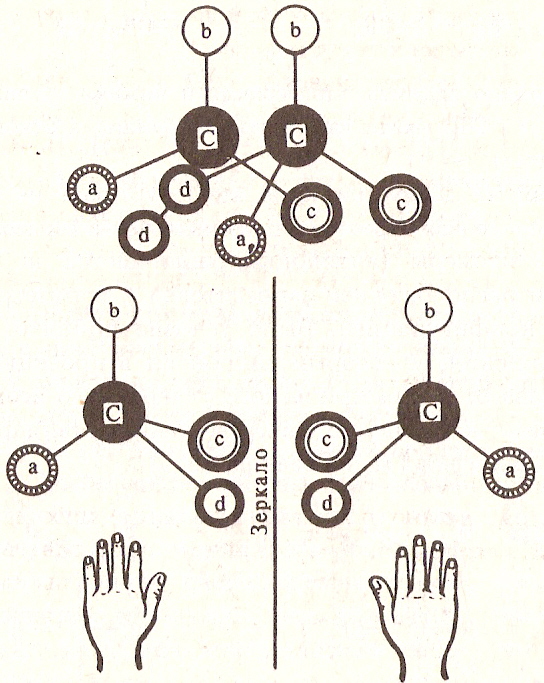
Таким образом оптическая изомерия- это явление, обусловленное хиральностью. Если молекула идентична своему зеркальному изображению- она ахиральна.
Оптические изомеры (антиподы) различаются не только знаком вращения, но и расположением заместителей у ассиметричного атома углерода, т.е. конфигурацией. Было установлено, что оптический активные вещества, у которых гидроксил в проекционной формуле находится справа от ассиметричного углеродного атома, относится к D-ряду, а слева- к L-ряду. Эти знаки не указывают направление вращения плоскости поляризации, а лишь информируют об относительном пространственном расположении групп у ассиметричного атома углерода. Поэтому знаки вращения и конфигурации могут и не совпадать.
Одним из простейших оптически активных веществ является молочная кислота. Она содержит один ассиметричный атом углерода и поэтому существует в трех формах: правовращающей, левовращающей и оптически недеятельной (рацемат):

Между числом ассиметрических атомов углерода в молекуле и числом оптических изомеров существует зависимость: N=2n, где n-число ассиметричных углеродных атомов.
ХИМИЧЕСКИЕ СВОЙСТВА
Химические свойства гидроксикислот определяются присутствием в них карбоксильной и гидроксильной групп. Поэтому они проявляют свойства спиртов и кислот. В этом и состоит особенность этих «химер»- кислотоспиртов (или спиртокислот)
Кислотные свойства
Как кислоты они способны образовывать соли, сложные эфиры, амиды и т.д. По карбоксильной группе для окискислот характерны все свойства карбоновых кислот
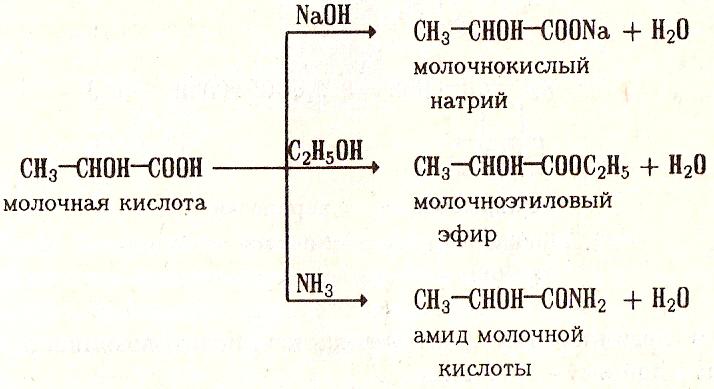
Основные свойства
Как спирты, гидроксикислоты способны образовывать алкоголяты, простые эфиры и галогенпроизводные
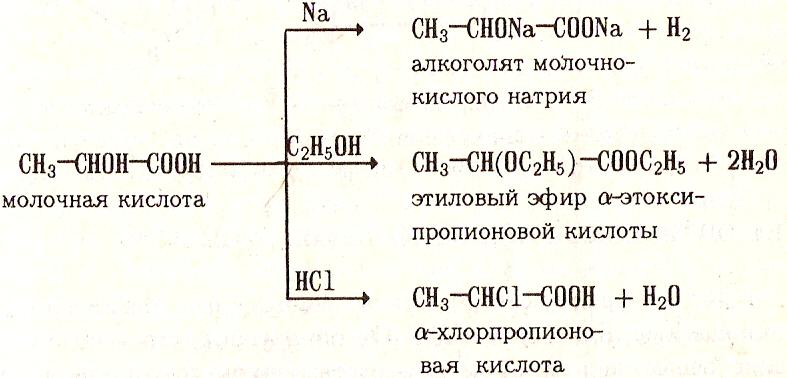
Дегидратация гидроксикислот (отношение к нагреванию)
По характеру образовавшихся продуктов после отщепления воды можно судить о строении гидроксикислот.
Так, при гидратации α-гидроксикислот образуется циклический продукт- лактид:
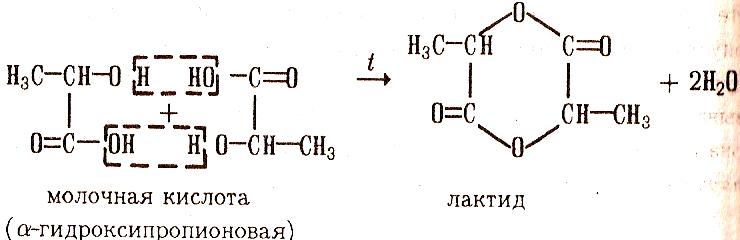
Дегидратация β-гидроксикислот приводит к непредельным кислотам:

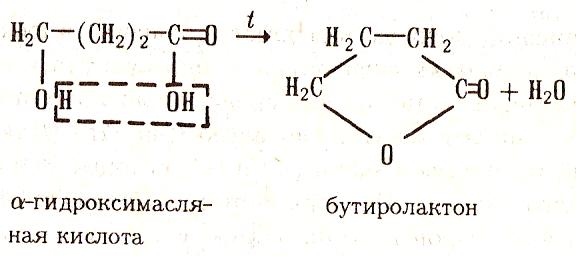
При дегидратации γ- т.д. гидроксикислот возникают внутренние сложные эфиры- лактоны:
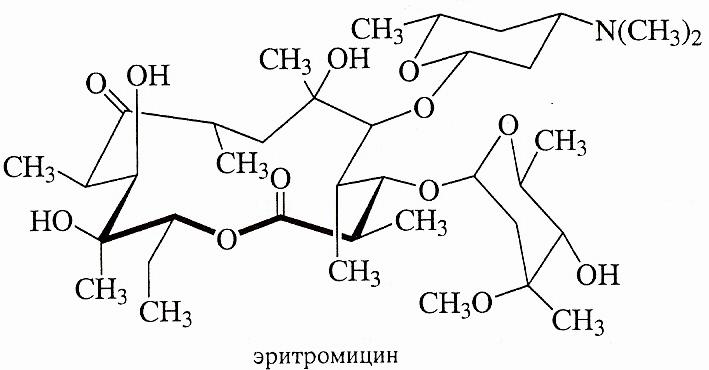
Многие природные соединения являются макроциклическими лактонами (макролидами). Например, антибиотик эритромицин содержит в своей структуре 14-членный лактонный цикл. Для медицинских целей его производят ферментативным путем, однако в лаборатории он получен и синтетически.
Оксикислоты широко распространены в растительном мире. Гликолевая кислота встречается во многих растениях - свекла, виноград). Молочная кислота является продуктом жизнедеятельности ряда бактерий. Она с незапамятных времен используется как консервирующее и предохраняющее от гниения вещество. Кислое молоко, простокваша, кефир- продукты молочнокислого брожения молока: молочный сахар-лактоза- превращается в молочную кислоту. Приготовление кислой капусты, моченых яблок, солка огурцов и помидоров- это процессы молочнокислого брожения сахаров, содержащихся в продуктах. Накапливающаяся молочная кислота обеспечивает сохранность этих продуктов. Силос- продукт молочнокислого брожения ботвы и зелени. В мышцах содержится молочная кислота, которая образуется из глюкозы и накапливается в мышцах. Ее предшественником является пировиноградная кислота.Яблочная кислота найдена в рябине, незрелых яблоках и многих других плодах. Винная кислота в свободном виде и в виде солей также находится во многих плодах. В виде труднорастворимой соли она осаждается в бочках с бродящим вином, и из этого «винного камня» и добывается виннокаменная кислота.
Лимонная кислота применяется в медицине, в пищевой промышленности (для изготовления экстрактов, напитков, конфет), в текстильной промышленности в качестве добавки в растворы красителей, при серебрении, в печатном деле.
Лимонная кислота очень полезна для организма, так как участвует в обмене веществ ( в превращениях цикла три- и дикарбоновых кислот).
ГИДРОКСИ- И АМИНОКАРБОНОВЫЕ КИСЛОТЫ БЕНЗОЛЬНОГО РЯДА
Ароматические оксикислоты бывают двух типов: фенолокислоты, у которых оксигруппа введена прямо в кольцо бензола, и спиртокислоты, у которых оксигруппа находится в боковой цепи.
Фенолокислоты обьединяют в себе химические свойства карбоновых кислот и соответствующих фенолов. При взаимодействии с карбонатами эти кислоты дают соли, а при взаимодействии с сильными щелочами- соли и феноляты. Многие из них дают цветные реакции с треххлористым железом.
Простейшим представителем спирто-кислот ароматического ряда является миндальная кислота- С6Н5СНОНСООН. Она впервые была получена из глюкозида миндаля путем гидролиза соляной кислотой и оказалась левого вращения. Миндальную кислоту легко получают синтетически- из бензальдегида и цианистого водорода через циангидрин с омылением последнего. Миндальная кислота обладает антисептическим действием
Наиболее распространенными представителями этих соединений являются салициловая и антраниловая кислоты, а также их пара-изомеры.
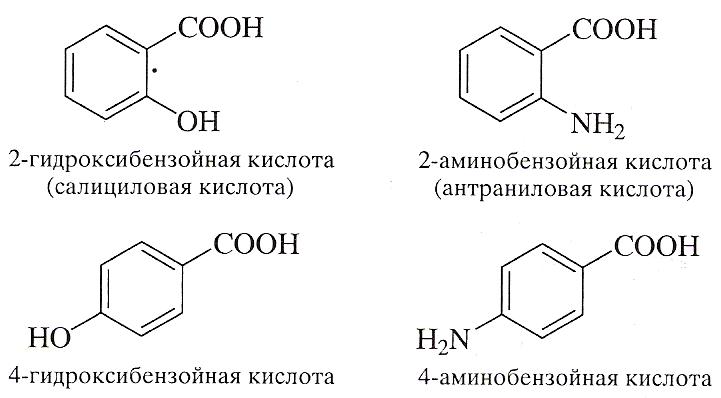
Сначала салициловая кислота была получена из гликозида салицина, содержащегося в коре ивы (salix).
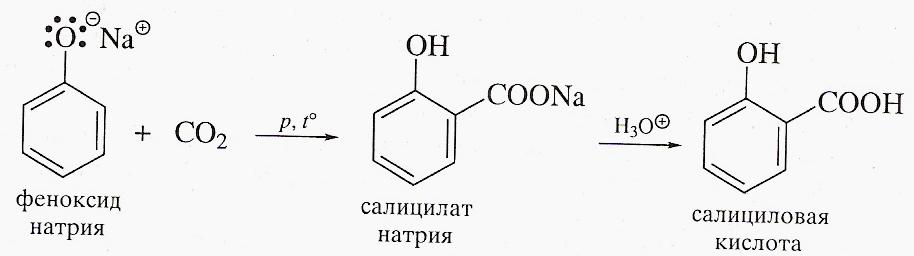
Основным промышленным способом получения салициловой кислоты является карбоксилирование феноксида натрия диоксидом углерода под давлением при 120-1300С. Салициловая кислота кристаллизуется в виде иголочек. Она трудно растворяется в воде, обладает сильным, сладко-кислым вкусом
Особенно широким применением пользуются следующие производные салициловой кислоты: метилсалицитат, ацетилсалициловая кислота (аспирин) и фенилсалицитат (салол). Применение в медицине этих трех производных салициловой кислоты основано на положительном физиологическом действии салициловой кислоты на стенки желудка. Все три сложных эфира в кислой среде желудка не гидролизируются в значительной мере, а поэтому проходят через желудок, не действуя на его стенки. Попавшие в щелочную среду кищечника сложные эфиры гидролизуются и освобождают салициловую кислоту как раз в месте, где необходимо ее действие. Аспирин употребляется в качестве жаропонижающего и анальгетического средства, салол является антисептиком, рекомендуемым при желудочно-кишечных заболеваниях.
Салициловая кислота является более сильной кислотой, чем бензойная
Салициловую кислоту применяют для получения лекарственных средств (аспирин), протравных красителей, душистых веществ, а также в качестве антисептика в пищевой промышленности при консервировании и как реагент в аналитической химии.
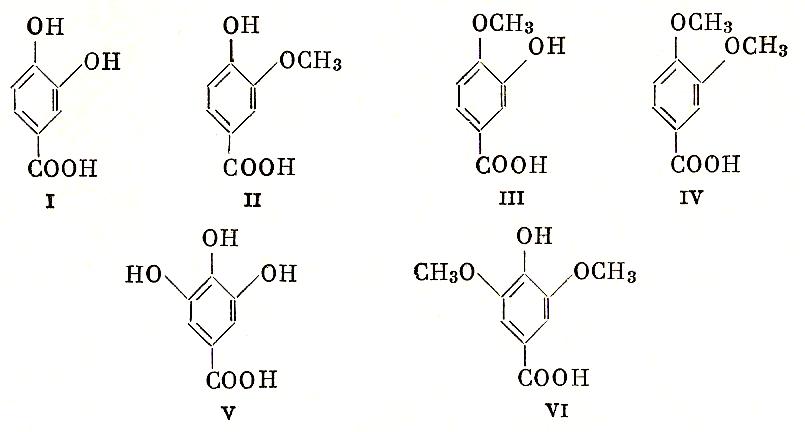
Полиоксибензойные кислоты весьма распространены в природе. Они содержатся в виде гликозидов или других производных во многих растениях такими являются, например- протокатеховая кислота (1) и ее производные: ванилиновая (2), изованилиновая (3) и вератровая (4) кислоты. Из триоксибенхзойных кислот наибольшее значение имеет 3,4,5триоксибензойная кислота (5)- одна из наиболее распространенных растительных кислот. Она содержится в листьях чая, корнях гранатового дерева. Иначе ее называют галловая. Она издавна применяется для производства чернил и ряда красок. Висмутовая соль этой кислоты применяется как сильный антисептик под названием дерматол. Диметиловый эфир галловой кислоты –сиреневая кислота (6) также получается при расщеплении многих природных соединений.
Образованные двумя молекулами ароматических поликислот сложные эфиры, в которых одна выступает как кислота, а другая как фенол, называются депсидами.
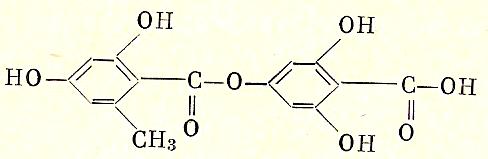
Дубильные вещества, экстрагируемые из некоторых растительных тканей (например, из коры дуба), представляют собой производные депсинов.
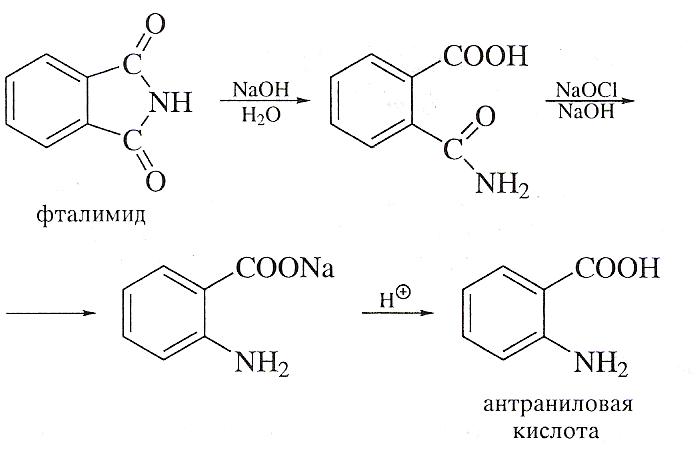
Для получения антраниловой кислоты чаще всего используют гипогалогенитную реакцию Гофмана, действуя на фталимид гипохлоритом натрия в щелочной среде. Антраниловая кислота -амфотерное соединение.
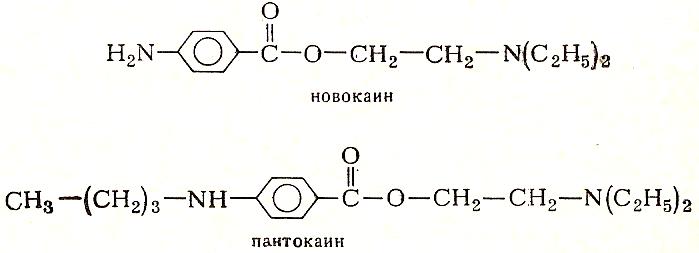
Антраниловую кислоту используют в производстве красителей, душистых веществ, пестицидов, лекарственных средств. Антраниловая кислота является промежуточным продуктом при синтезе индиго синего, а также ряда азокрасителей. Метиловый эфир антраниловой кислоты в ходит в состав эфирного масла жасмина, он обладает запахом земляники и употребляется в парфюмерии. n-антраниловая кислота применяется для синтеза ряда анестезирующих средств: анестезина, новокаина и пантокаина.
Эта кислота (антраниловая) - фактор роста многих микроорганизмов. Действие сульфамидных препаратов состоит именно в том, что эти препараты подменяют необходимую для жизни микроорганизмов антраниловую кислоту. Достаточная концентрация этих веществ в крови приводит к гибели бактерий. Антраниловая кислота- важное антитуберкулезное лекарство, действующее по тому же принципу.
