
- •1.Классификация по типу превращения субстрата
- •2.Классификация по типу активирования.
- •3.Классификация по характеру разрыва связей.
- •4.Одноэлектронные реакции
- •1. Природные источники.
- •4. Способы получения (методы синтеза).
- •5. Химические свойства.
- •2. Перициклические реакции.
- •Металлоорганический синтез.
- •Гидрирование бензола и его гомологов.
- •Пиролиз солей дикарбоновых кислот.
- •Дегалогенирование вицинальных дигалогеналканов.
- •Реакция Виттига.
- •Дегидрирование и крекинг алканов.
- •Дегидратация спиртов (элиминирование).
- •Дегидрогалогенирование галогеналканов.
- •Галогенирование алкенов.
- •Гидрогалогенирование.
- •Гидратация.
- •4. Присоединение спиртов.
- •5. Оксимеркурирование.
- •6. Гидроборирование.
- •7. Присоединение хлорноватистой кислоты.
- •8. Окисление.
- •Карбидный способ.
- •Пиролиз этилена и метана.
- •Дегалогенирование дигалогеннидов и галогеналкенов.
- •Гидролиз
- •1. Галогенангидриды
- •Ацилирование хлорангидридами
- •Восстановление хлорангидридов
- •2.Ангидриды карбоновых кислот
- •3.Сложные эфиры
- •Нитрилы
- •Альдегидо- и кетокислоты.
- •Строение и таутомерия ацетоуксусного эфира
- •Нитросоединения
- •Восстановление нитросоединений
- •2. Действие азотистой кислоты.
- •Реакция анри ( конденсация нитроалканов с альдегидами)
- •Диазосоединения
- •Элементорганические соединения
- •Активные металлоорганические соединения
- •I , II и III групп
- •Вторая группа периодической системы
- •Третья группа периодической системы
- •Четвертая группа периодической системы
- •Пятая группа периодической системы
- •Аминокислоты. Белки.
- •Пятичленные гетероциклы с одним гетероатомом и их производные.
- •Шестичленные и конденсированные гетероциклические соединения. Алкалоиды.
- •Серосодержащие органические соединения
3.Сложные эфиры
В названии сложного эфира сначала указывают алкильную группу, связанную с кислородом, затем кислоту, заменяя суффикс в названии кислоты –овая кислота на суффикс -оат.

Многие представители сложных эфиров встречаются в природе: душистые вещества, феромоны, жиры и масла:

СПОСОБЫ ПОЛУЧЕНИЯ.
Этерификация карбоновых кислот спиртами (главным образом первичными) в присутствии кислотных катализаторов:

Ацилирование спиртов и фенолов хлорангидридами карбоновых кислот. Чаще всего, эту реакцию проводят в присутствии оснований для нейтрализации выделяющегося НС1. Ароматические ацилгалогениды реагируют медленнее, чем алифатические. По методу Шоттена-Баумана реакции ацилирования хлорангидридов проводят в водных растворах щелочей:

Ацилирование спиртов и фенолов ангидридами карбоновых кислот.
Этим методом обычно получают эфиры уксусной кислоты.

Присоединение спиртов и фенолов к кетенам:

ХИМИЧЕСКИЕ СВОЙСТВА
Гидролиз:
Сложные эфиры весьма устойчивы в нейтральной водной среде, но легко расщепляются, будучи нагреты с водой в присутствии сильных кислот или оснований.
Гидролиз сложных эфиров в присутствии минеральной кислоты протекает как реакция, обратная реакции этерификации:
 Гидролиз сложных
эфиров карбоновых кислот в присутствии
оснований приводит к получению солей
карбоновых кислот и называется омылением.
Гидролиз сложных
эфиров карбоновых кислот в присутствии
оснований приводит к получению солей
карбоновых кислот и называется омылением.

Переэтерификация.
Превращение одного сложного эфира в другой под действием соответствующего спирта в присутствии катализатора (кислоты или основания) называют переэтерификацией.
Эта реакция обратима, равновесие можно смещать отгонкой низкокипящего спирта.

Восстановление:
- Сложные эфиры восстанавливаются с разрывом связи между карбонильным атомом углерода и кислородом алкоксигруппы. При этом ацильный остаток восстанавливается до первичного спирта. Литийалюминийгидрид является для этих целей наиболее эффективным восстановителем:

- Восстановление можно проводить также действием натрия в этаноле (реакция Буво-Блана). Этот способ дает хорошие результаты при восстановлении эфиров алифатических кислот:

-сложноэфирная конденсация Кляйзена. Эта реакция приводит к получению β-кетокарбоновых кислот. (слайд)
АМИДЫ
При составлении названия амида суффикс в названии –овая кислота заменяют на суффикс –амид.
Правила составления названий иллюстрируются следующими примерами:
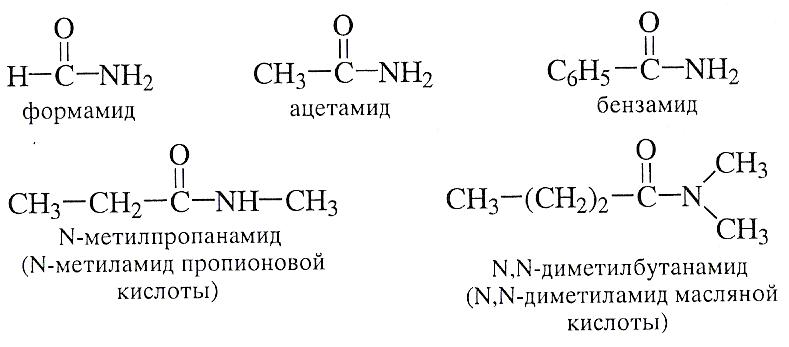
СПОСОБЫ ПОЛУЧЕНИЯ.
Амиды являются наименее реакционноспособными производными карбоновых кислот по отношению к нуклеофильным агентам. Поэтому для получения амида пригодна реакция любого производного карбоновой кислоты с аммиаком или соответствующим амином.
Амиды получают несколькими способами:
- из ацилгалогенидов ацилированием аммиака, первичных и вторичных аминов;
- из ангидридов взаимодействием с аммиаком и аминами, этим способом обычно получают различные ацетамиды;
- из сложных эфиров взаимодействием с аммиаком и аминами;
- из карбоновых кислот взаимодействием с аммиаком и аминами;
- гидролиз нитрилов- реакция идет гладко в присутствии как кислот, так и оснований:
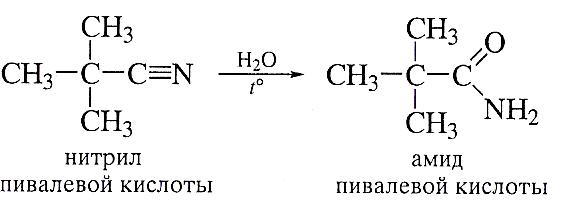
Для ускорения реакции в щелочной среде иногда применяют пероксид водорода

- из кетенов присоединением первичных и вторичных аминов:

ХИМИЧЕСКИЕ СВОЙСТВА
Амидная группа имеет плоское строение.
Амиды обладают повышенной кислотностью. Они являются более сильными кислотами, чем аммиак. В водных растворах амиды не образуют устойчивых солей ни как основания, ни как кислоты, т.е. являются нейтральными соединениями

Превращение амидов в нитрилы
Превращение амида карбоновой кислоты в нитрил протекает как под действием высокой температуры, так и при обработке амида дегидратурирующими агентами (P2O5, POCl3, SOCl2):
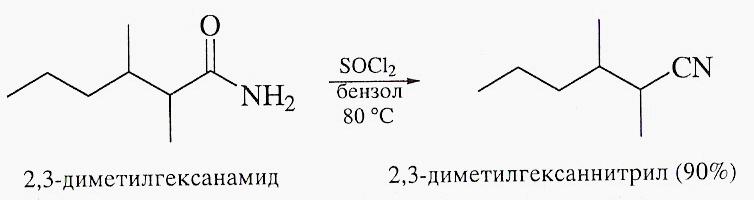
Гидролиз амидов:
Гидролиз проводят при их нагревании с водой в присутствии оснований (реже в присутствии кислот). В результате реакции образуются карбоновая кислота и аммиак (или амин):

Гипогалогенитная реакция Гофмана.
Реакция амидов со щелочными растворами галогенов (иода, брома, хлора) известна как реакция Гофмана. Эта реакция называется также перегруппировкой Гофмана. Ведет она к получению амина с укорочением углеродной цепи амида на один атом углерода. Реакция гладко протекает с амидами как жирных, так и ароматических кислот:

Восстановление амидов.
Восстановление проводят действием литийалюминийгидрида (как правили в избытке) в эфире или тетрагидрофуране. В качестве восстановителя можно применять и диборан:

