
- •Введение в органическую химию Оглавление
- •Введение в органическую химию
- •Бутан изобутан
- •Бутан изобутан
- •Пентан изопентан неопентан
- •Пропан бутан изобутан пентан изопентан неопентан
- •Классификация и номенклатура
- •1.1. Углеводороды
- •Пропан пропен (пропилен) пропин (метилацетилен)
- •1.2. Функциональные группы
- •2. Ковалентная связь
- •2.1. Электроотрицательность и виды связей
- •Связь Разница в Тип связи
- •2.2. Углы между связями и форма молекул
- •2.3. Атомные и молекулярные орбитали
- •Основное состояние возбужденное состояние атома углерода
- •2P орбиталей углерода с образованием четырех sp3-гибридных орбиталей.
- •Ао атома углерода и ао четырех атомов водорода.
- •2.4. Длина и энергия связи
- •3. Кислоты и основания
- •3.1. Кислоты и основания по Бренстеду-Лоури
- •3.2. Строение молекулы и кислотность
- •3.3. Кислоты и основания Льюиса
- •4. Хиральность
- •4.1. Энантиомерия.
- •4.2. Стереохимическая номенклатура
2.3. Атомные и молекулярные орбитали
Отрицательно заряженные электроны располагаются вокруг положительно заряженных ядер атомов на орбиталях. Орбиталь s имеет форму шара, а p - гантели. Одна из ветвей гантели имеет положительное значение фазы, а другая - отрицательное.

S орбиталь p орбиталь
Связь между атомами возникает в результате перекрывания атомных орбиталей (АО). Чем больше это перекрывание, тем прочнее связь. Перекрываясь, АО образуют молекулярные орбитали (МО), и вся молекула рассматривается как многоядерная многоэлектронная система, в которой общие для всей молекулы электроны расселяются по различным МО.
При образовании молекулы водорода из атомов по мере их сближения 1s орбитали начинают перекрываться и АО превращаются в МО молекулы водорода, по которым начинают двигаться оба электрона. На каждой МО может находиться не более двух электронов и то с разными спинами (принцип Паули). В случае образования молекулы водорода комбинация двух АО дает две МО: связующую, на которой и будут располагаться оба электрона, и разрыхляющую.
![]()
Рис. 1. Перекрывание двух АО 1s с образованием связующей МО.
![]()
Рис. 2. Перекрывание двух АО 1s с образованием разрыхляющей МО.
Относительная энергия электрона на связующей МО молекулы водорода значительно меньше энергии на АО атома водорода, в то время как относительная энергия электрона на разрыхляющей МО молекулы водорода значительно больше энергии на АО атома водорода. Энергетическая диаграмма МО молекулы водорода показана на рис.3.

Рис. 3. Энергетическая диаграмма молекулы водорода.
Комбинация двух АО дает две МО.
p-Орбитали могут перекрываться двумя путями. Первый способ перекрывания (рис. 4а) осуществляется в том случае, когда оси перекрывающихся орбиталей лежат на одной прямой. При этом перекрывающиеся доли p-орбиталей должны иметь одинаковый знак. Образующаяся в этом случае связь имеет форму эллипса и называется -связью. При втором типе перекрывания (рис. 1.4б) оси p-орбиталей параллельны и образующаяся при этом МО будет состоять из двух частей - над и под плоскостью касания орбиталей. Такая МО по форме напоминает p-орбиталь, ее называют -орбиталью, а соответствующую ей связь – -связью.

Рис. 4. Перекрывание двух АО 2p с образованием связующих а) -МО и б) -МО.
А. Гибридизация атомных орбиталей
Электронная конфигурация валентного слоя атома углерода предполагает его двухвалентность, однако, в метане, как и в других соединениях, атом углерода образует с другими атомами четыре связи.


Основное состояние возбужденное состояние атома углерода
Для объяснения образования углеродом четырех одинарных связей вводится понятие гибридизации орбиталей: линейная комбинация четырех математических функций орбиталей активированного атома углерода может приводить к функциям четырех эквивалентных орбиталей, что позволяет описать молекулу метана более реалистично. В этой модели одна s и три p орбитали смешиваются (гибридизуются) и дают четыре новые гибридные орбитали:
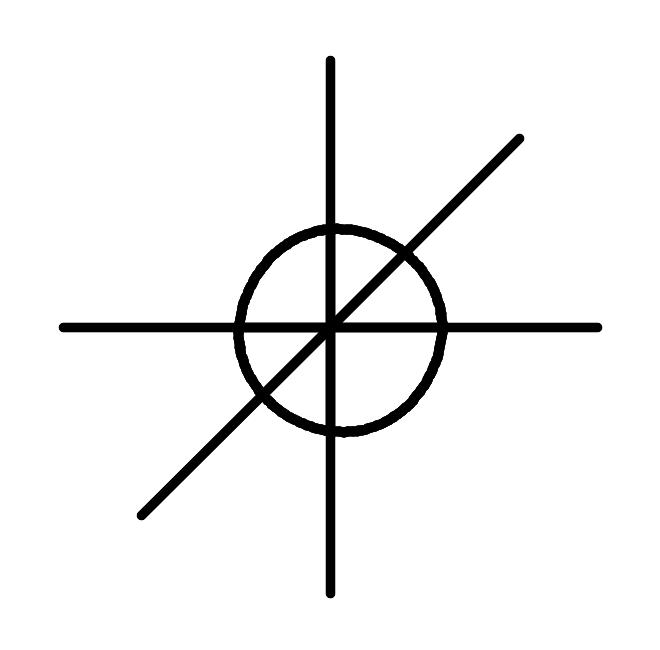
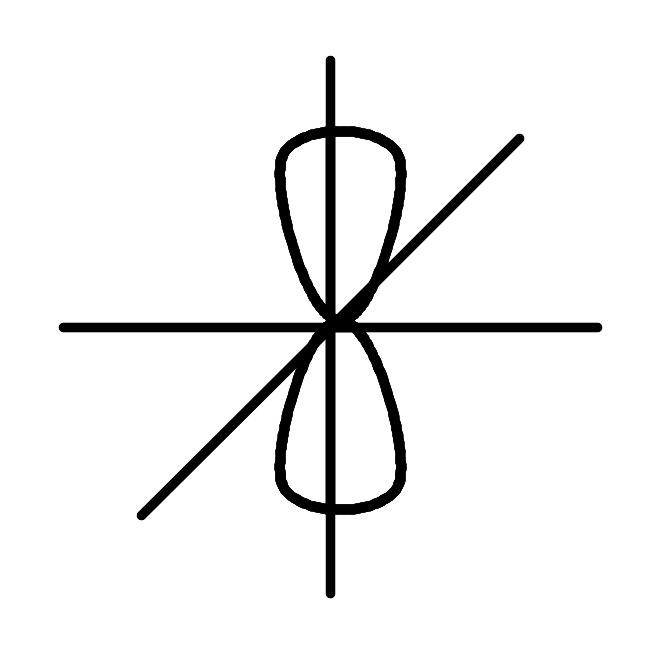

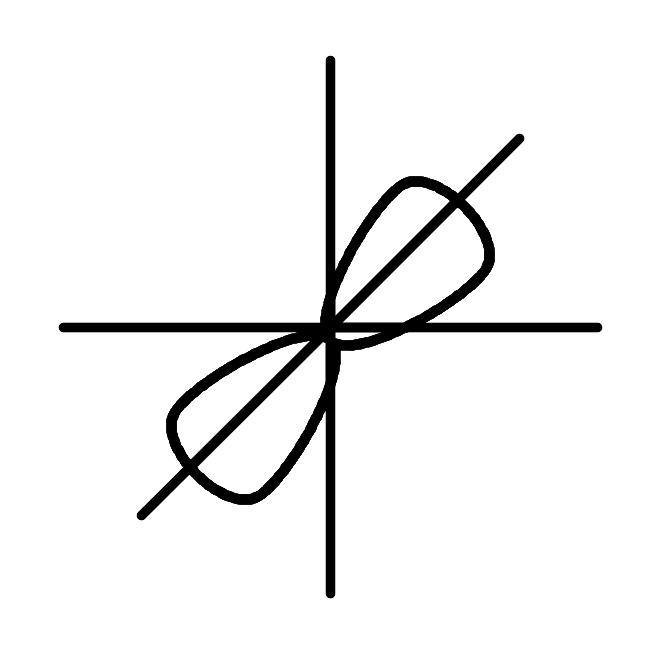
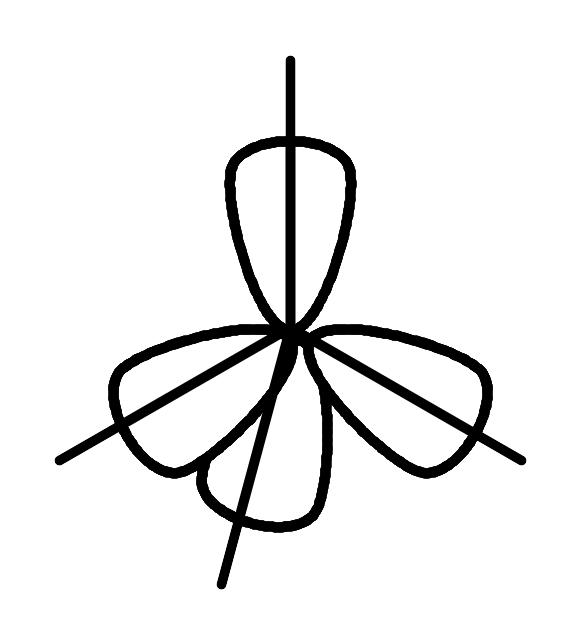
Рис.5. Изображение математической процедуры гибридизации одной 2s и трех
